Wei-Phos配體(以周偉博士名字命名的配體)是張俊良教授課題組基于非C2對稱性���、剛?cè)岵?jì)和兼具軟硬配位原子(O, S, N, P原子)的設(shè)計(jì)理念,開發(fā)的第一例雙膦Sadphos(Sulfinamide Phosphine的簡稱)配體���。該配體從商業(yè)可得2-二芳基膦芳基甲醛出發(fā)���,與叔丁基亞磺酰胺縮合制備亞胺,之后與二苯基膦亞甲基鋰進(jìn)行加成���,經(jīng)過兩步反應(yīng)即可通過柱層析或重結(jié)晶方便獲得(圖1)[1]���。目前��,Wei-Phos在手性膦催化、手性高分子材料合成和不對稱金屬催化領(lǐng)域表現(xiàn)出優(yōu)異的催化活性和手性誘導(dǎo)能力(圖 1)����。下面,將按照反應(yīng)類型對Wei-Phos配體在不對稱轉(zhuǎn)化中的應(yīng)用進(jìn)展做簡要介紹�。
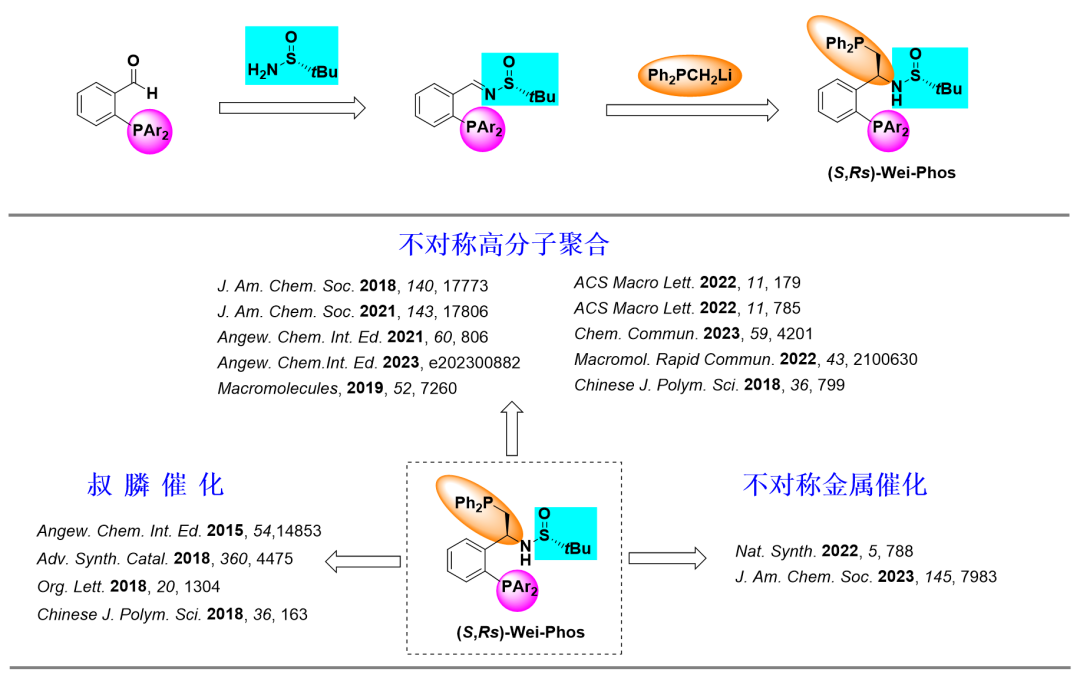
圖1. Wei-Phos 的合成及應(yīng)用
叔膦催化是有機(jī)催化的重要組成部分,近幾十年來�����,以Morita-Baylis-Hillman反應(yīng)�、Rauhut–Currier反應(yīng)和陸氏[3+2]環(huán)加成等為代表的叔膦催化反應(yīng)已經(jīng)成為構(gòu)建官能化有機(jī)分子的重要合成手段,部分轉(zhuǎn)化已成功應(yīng)用于天然產(chǎn)物的合成中�。在叔膦催化領(lǐng)域,新型高效手性膦催化劑的開發(fā)一直備受化學(xué)家廣泛關(guān)注���,具有很大挑戰(zhàn)性�。針對這一難題�����,張俊良教授課題組從商業(yè)可得2-二芳基膦芳基甲醛出發(fā),與叔丁基亞磺酰胺縮合制備亞胺���,之后與二苯基膦亞甲基鋰進(jìn)行加成�,簡潔高效構(gòu)建了一系列β-氨基手性雙膦催化劑(Wei-Phos)并考察了其應(yīng)用�����。
Rauhut–Currier反應(yīng)是一個高效構(gòu)筑碳-碳鍵的基礎(chǔ)反應(yīng)����,具有高原子經(jīng)濟(jì)性、產(chǎn)物含多種官能團(tuán)的優(yōu)點(diǎn)�。自該反應(yīng)被發(fā)現(xiàn)以來,一直存在著局限性����,如不同烯烴的交叉反應(yīng)沒有選擇性,催化劑用量大��,反應(yīng)底物范圍不廣��。張俊良教授課題組針對Rauhut–Currier反應(yīng)的缺點(diǎn)���,通過新催化劑的開發(fā)����,成功實(shí)現(xiàn)了不同活潑烯烴間的不對稱交叉Rauhut–Currier反應(yīng)(圖2)。機(jī)理研究表明�,在反應(yīng)過程中Wei-Phos中的兩個叔膦單元各司其職:二苯基亞甲基膦部分電子云密度較高,在反應(yīng)過程中起到親核加成的催化作用�����;三芳基膦部分電子云密度較低���,在反應(yīng)過程中扮演剛性位阻的作用。
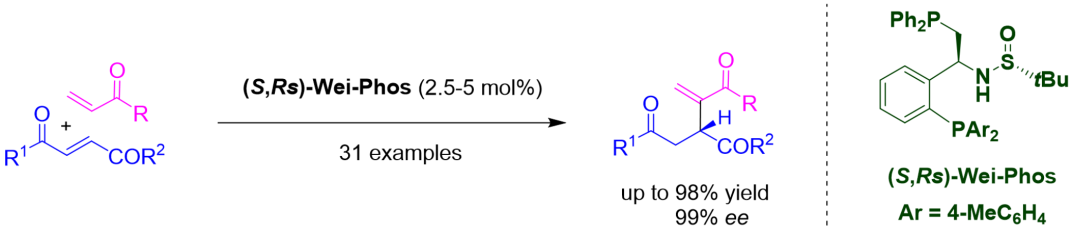
圖2. Wei-Phos 在不對稱分子間Rauhut–Currier反應(yīng)中的應(yīng)用
2018年����,張俊良教授課題組對Wei-Phos進(jìn)行了進(jìn)一步修飾。Wei-Phos中叔丁基亞磺?���;糠衷谒嵝詶l件下可以被脫除,進(jìn)而引入酰胺或與氨基酸縮合得到具有更強(qiáng)氫鍵供體能力的催化劑����。隨后張俊良教授將這類新修飾的催化劑應(yīng)用于鄰亞甲基苯醌 (o-QMs)與MBH碳酸酯的[4+1]環(huán)加成反應(yīng)中�����,取得了優(yōu)異的對映選擇性(圖3)
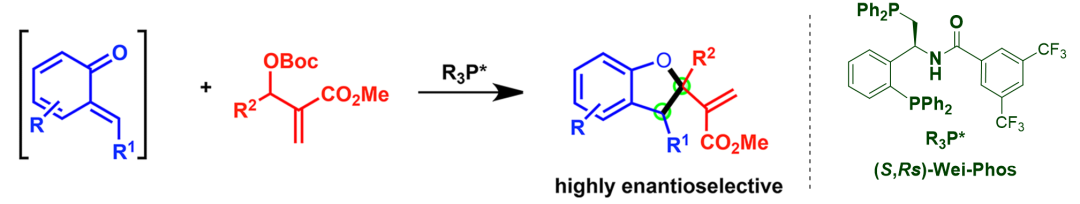
圖3. Wei-Phos 催化o-QMs與MBH碳酸酯不對稱 [4+1]環(huán)加成反應(yīng)
同年�,華東理工大學(xué)李浩教授課題組也利用修飾后的Wei-Phos實(shí)現(xiàn)了2-烯基吡啶與活潑烯烴間的不對稱Rauhut–Currier反應(yīng)�����,取得了良好的產(chǎn)率和優(yōu)異的對映選擇性(圖4)[3]��。李浩教授課題組的這一研究工作進(jìn)一步拓展了 Rauhut–Currier反應(yīng)的底物范圍���,為官能化的手性吡啶化合物的構(gòu)建提供了一種新的途徑���。
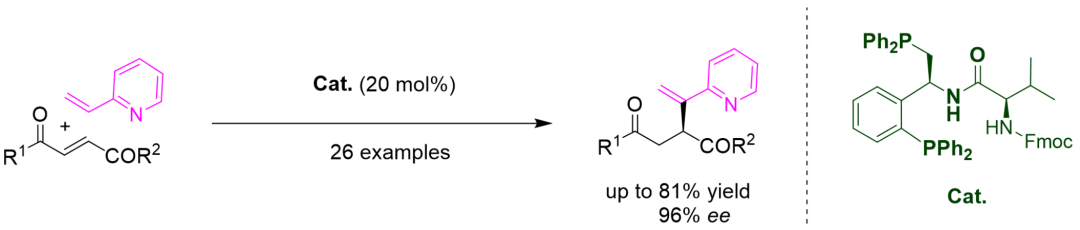
圖4. Wei-Phos 催化2-烯基吡啶與活潑烯烴不對稱分子間Rauhut–Currier反應(yīng)
手性聚合物是一類特殊的高分子材料,具有區(qū)別于傳統(tǒng)高分子材料的特殊性質(zhì)��,比如空間排布��、材料強(qiáng)度��、介電性能以及可塑性等方面�。而這些特殊的性質(zhì)賦予了手性聚合物獨(dú)特的功能和應(yīng)用,如手性分離材料��、手性液晶材料、手性傳感材料和手性電磁材料等��。因此��,手性聚合物材料的合成具有重要的科學(xué)意義和市場價值���。手性催化劑誘導(dǎo)非手性單體的立體選擇性聚合是構(gòu)建手性高分子材料的重要途徑之一�����。近年來Wei-Phos在不對稱高分子聚合領(lǐng)域的應(yīng)用越來越廣泛�,在多種聚合反應(yīng)中表現(xiàn)出了優(yōu)異的催化活性和手性誘導(dǎo)能力�。
高分子端基功能化是指在高分子聚合物的端基上引入新的功能基團(tuán)����,賦予其性質(zhì)和功能,是高分子功能化的重要手段�。2018年,合肥工業(yè)大學(xué)吳宗銓教授課題組利用鈀/Wei-Phos催化體系實(shí)現(xiàn)了螺旋聚卡賓的高效活性可控合成�����,制備出了一種結(jié)構(gòu)新穎的螺旋高分子(圖5)���。
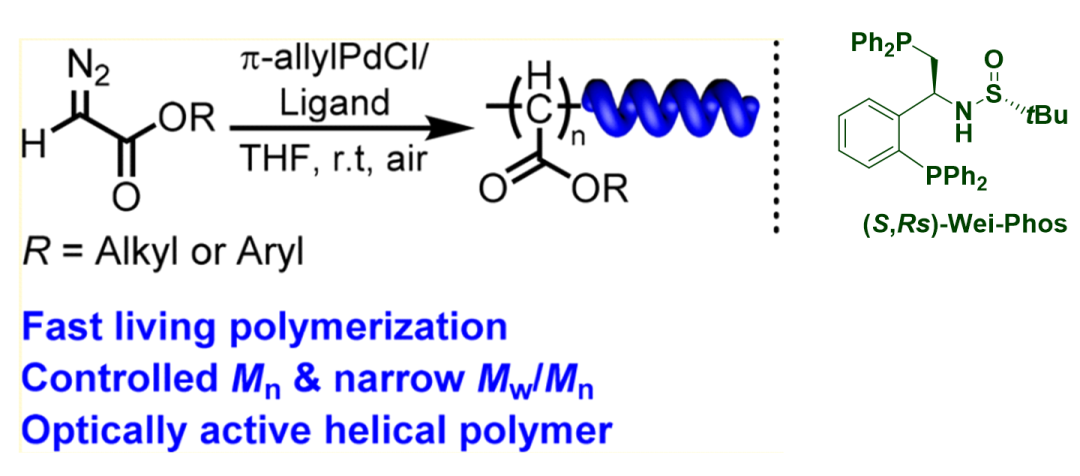 圖5. Wei-Phos 在合成螺旋聚卡賓中的應(yīng)用
圖5. Wei-Phos 在合成螺旋聚卡賓中的應(yīng)用
環(huán)丙烯類(CPEs)是最小的不飽和環(huán)狀化合物�����,它們因極高的環(huán)張力而表現(xiàn)出豐富的反應(yīng)性��,被廣泛應(yīng)用在有機(jī)合成和開環(huán)易位聚合(ROMP)方面��,但是環(huán)丙烯中乙烯基的加聚反應(yīng)研究報道較少����,相關(guān)的活性/可控聚合仍是一個極大的難題,主要的難點(diǎn)在于聚合過程中的動力學(xué)障礙和中間體的內(nèi)在不穩(wěn)定性����。2021年,北京大學(xué)王劍波教授團(tuán)隊(duì)以[Pd(allyl)Cl]2為Pd源����、Wei-Phos為配體,成功報道了一例催化環(huán)丙烯類化合物的活性/可控乙烯基加聚反應(yīng)[9]�,通過該反應(yīng)可以得到包含完全飽和的剛性三元環(huán)結(jié)構(gòu)的主鏈聚合物(圖7),產(chǎn)率中等偏上��,并且具有可控的Mn和較小的Mw/Mn值���。
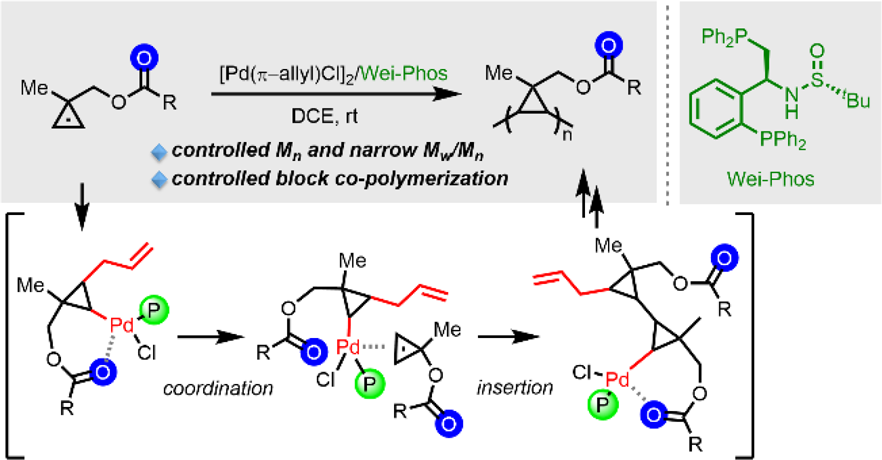 圖7. Wei-Phos 在環(huán)丙烯聚合中的應(yīng)用
圖7. Wei-Phos 在環(huán)丙烯聚合中的應(yīng)用
三����、不對稱金屬催化
可見光催化作為一種綠色、可持續(xù)的新興策略��,被廣泛用于有機(jī)合成領(lǐng)域�����。有機(jī)化學(xué)家結(jié)合不對稱有機(jī)催化���、過渡金屬催化����、酶催化等立體控制策略發(fā)展了有效的不對稱可見光催化策略�����。盡管近幾年該領(lǐng)域得到了快速的發(fā)展��,但主要用于中心手性化合物合成�。近日�,華中師范大學(xué)的肖文精���、陸良秋團(tuán)隊(duì)報道了首例可見光誘導(dǎo)的不對稱鈷/Wei-Phos協(xié)同催化自由基偶聯(lián)反應(yīng),實(shí)現(xiàn)了外消旋聯(lián)雜芳基化合物動態(tài)動力學(xué)不對稱轉(zhuǎn)化(圖8)����。該反應(yīng)成功的關(guān)鍵在于氧化加成后形成的軸手性芳基鈷物種由于吡啶的配位作用,減小了旋轉(zhuǎn)能壘和消旋化�����,隨后立體選擇性地捕獲光催化產(chǎn)生的自由基��。
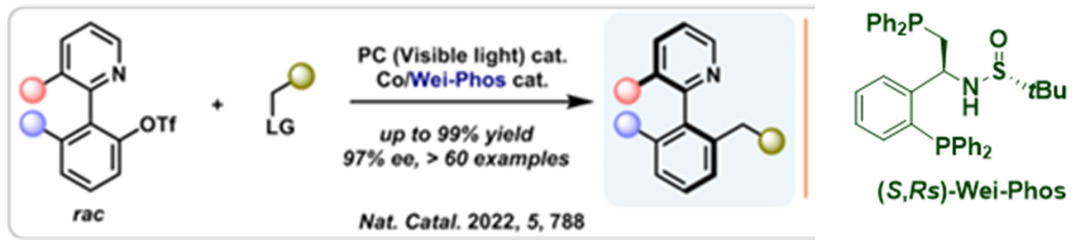
圖8. Wei-Phos 在光催化自由基不對稱偶聯(lián)中的應(yīng)用
近日�����,肖文精教授課題組進(jìn)一步研究了光誘導(dǎo)鈷催化動態(tài)動力學(xué)還原共軛加成反應(yīng)�,Wei-Phos在上述反應(yīng)中依然保持了優(yōu)異的催化活性和手性誘導(dǎo)能力(圖9)?���;谏鲜霾呗裕の木淌谂c合作者成功合成了一系列具有軸手性的雜二芳基衍生物(45個實(shí)例���,收率高達(dá)91%��,ee高達(dá)97%)�。該反應(yīng)具有反應(yīng)條件溫和、官能團(tuán)耐受性良好�、對映選擇性出色等特點(diǎn)。值得注意的是�����,該條件可避免大量金屬廢物的生成以及貴金屬催化劑的使用�。
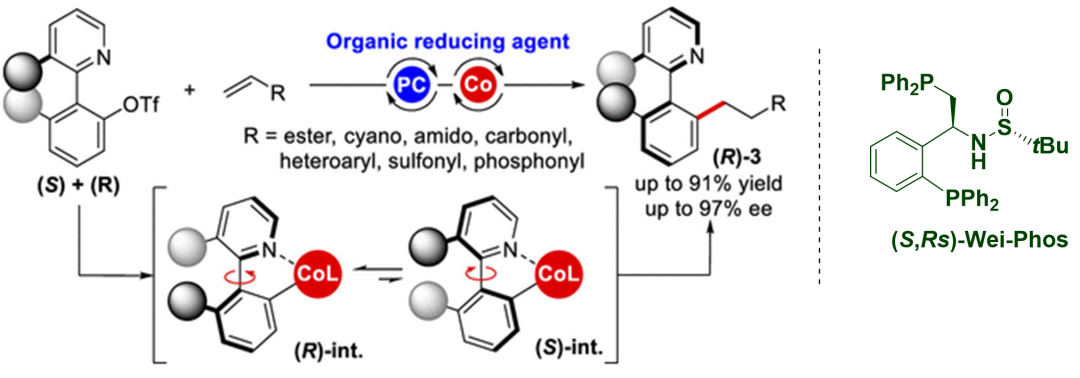
圖9. Wei-Phos 在光催化自由基不對稱加成中的應(yīng)用
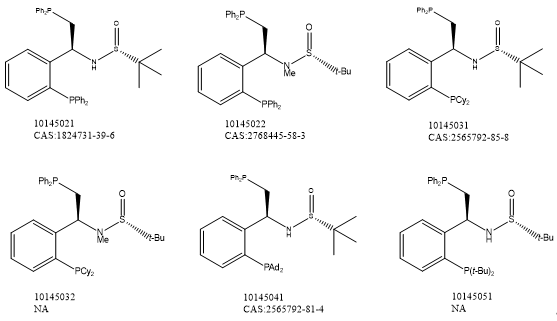
相關(guān)產(chǎn)品推薦
凱若利專注于研發(fā)各類手性催化劑,手性技術(shù)相關(guān)的技術(shù)開發(fā),技術(shù)轉(zhuǎn)讓��。能夠提供各類手性NHC配體��,質(zhì)量可靠穩(wěn)定����,能夠供應(yīng)從毫克級到公斤級的產(chǎn)品。以下是部分手性NHC配體�����,更多系列產(chǎn)品請?jiān)斣儭?/span>