三陰性乳腺癌(Triple-negative breastcancer,TNBC)是指雌激素受體(ER)、孕激素受體(PR)和人表皮生長因子(HER-2)均表達為陰性的乳腺癌�。TNBC被稱為乳腺癌中的“頭號殺手”——其侵襲性強��、易轉移且缺乏有效靶點����,在所有乳腺癌患者中,TNBC患者的復發(fā)和轉移風險最高���。傳統(tǒng)化療在TNBC患者中療效有限��,免疫療法作為一種新的抗腫瘤治療策略�,在治療某些實體瘤方面取得了突破性進展,但對晚期TNBC的療效欠佳�����,這可能是因為腫瘤免疫微環(huán)境(Tumor immune microenvironment���,TIM)所致�����。因此�,迫切需要新的靶點或治療策略來增強TNBC免疫治療的效果�。
2月25日,中國科學技術大學研究團隊在《Advanced Science》上發(fā)表了題為“Reprogramming the Tumor Immune Microenvironment with ICAM-1-Targeted Antibody?Drug Conjugates and B7-H3-CD3 Bispecific Antibodies”的研究論文�����。

重編程TIM對于促進免疫"冷"腫瘤向"熱"炎癥性腫瘤的轉化具有重要作用�。其中提升藥物靶向性、阻斷免疫檢查點通路以及促進免疫細胞活化是重編程TIM的關鍵策略��。本研究選擇細胞間黏附分子1(ICAM-1)靶向抗體-藥物偶聯(lián)物聯(lián)合B7-H3-CD3雙特異性抗體進行TIM重編程,顯著提升了三陰性乳腺癌的免疫治療效果���。該聯(lián)合療法通過增強藥物靶向遞送�、阻斷免疫檢查點信號通路����、激活效應T細胞釋放細胞因子,誘導腫瘤細胞發(fā)生免疫原性死亡并釋放腫瘤相關抗原�。這一效應可促進樹突狀細胞成熟、細胞毒性CD8+T細胞浸潤活化�、M1型巨噬細胞復極化,同時減少M2型巨噬細胞�、免疫抑制性Treg細胞及髓源抑制細胞(MDSC)的數(shù)量,從而實現(xiàn)TIM的重編程�����。值得注意的是�����,該創(chuàng)新策略還能促進免疫細胞在轉移灶部位的聚集����,顯著抑制肺轉移病灶的進展。
本研究為基于抗體-藥物偶聯(lián)物(ADC)與B7-H3-CD3雙特異性抗體的協(xié)同作用開發(fā)新型免疫治療策略重編程TIM提供了新思路���。
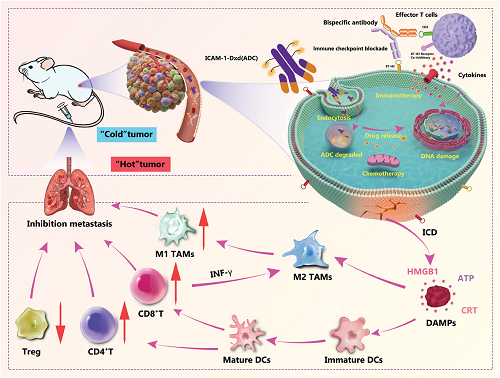
圖1. ICAM-1靶向抗體藥物偶聯(lián)物聯(lián)合B7-H3-CD3雙特異性抗體通過同步免疫治療與靶向治療重編程TIM以增強療效的示意圖
一�、核心機制:從“冷”腫瘤到“熱”腫瘤的轉變
TIM中的免疫抑制性細胞(如M2型巨噬細胞�����、調節(jié)性T細胞Tregs等)和免疫檢查點分子(如B7-H3)是導致腫瘤免疫逃逸的關鍵因素��。
1.ICAM-1靶向ADC的精準打擊
ICAM-1在TNBC細胞表面高表達�����,與腫瘤轉移和不良預后密切相關�。研究團隊開發(fā)的ICAM-1-DxdADC通過靶向ICAM-1,精準遞送化療藥物Dxd至腫瘤細胞����,誘導免疫原性細胞死亡(ICD),釋放腫瘤相關抗原(TAAs)和危險信號分子(DAMPs)�,如ATP、HMGB1等���,激活樹突狀細胞(DCs)和細胞毒性T細胞�。
2.B7-H3-CD3雙特異性抗體的免疫激活
B7-H3在多種腫瘤中高表達,可抑制T細胞功能�。研究中使用的B7-H3-CD3雙特異性抗體通過同時結合腫瘤細胞表面的B7-H3和T細胞表面的CD3,重編程免疫突觸�����,激活T細胞并增強其對腫瘤細胞的殺傷能力��。此外����,該抗體還能促進M2型巨噬細胞向M1型極化,減少免疫抑制細胞的浸潤���,從而逆轉TIM的免疫抑制狀態(tài)�����。
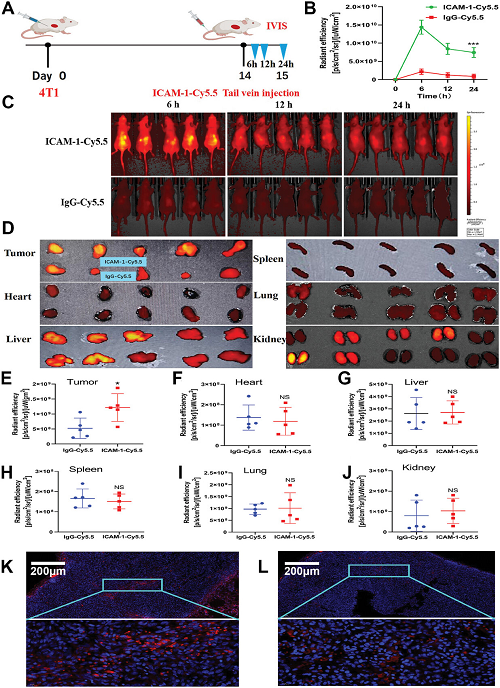
圖2. ICAM-1抗體的特異性識別和生物分布
二����、實驗驗證:聯(lián)合療法顯著抑制腫瘤生長和轉移
1.體外實驗
ICAM-1-Dxd對TNBC細胞系(如MDA-MB-231��、4T1)表現(xiàn)出高選擇性毒性����,其IC50值比非靶向ADC低約200倍。聯(lián)合B7-H3-CD3雙特異性抗體后����,腫瘤細胞凋亡率顯著增加,并伴隨DAMPs釋放和T細胞激活標志物的上調�����。
2.體內實驗
在4T1小鼠模型中�����,聯(lián)合治療組腫瘤生長抑制率高達97.8%����,肺轉移結節(jié)數(shù)量減少86.7%,生存期顯著延長�����。免疫組化分析顯示��,聯(lián)合治療促進了CD8+T細胞浸潤���,減少了M2型巨噬細胞和Tregs的比例��,同時上調了促炎細胞因子(如IFN-γ�、TNF-α)的表達。
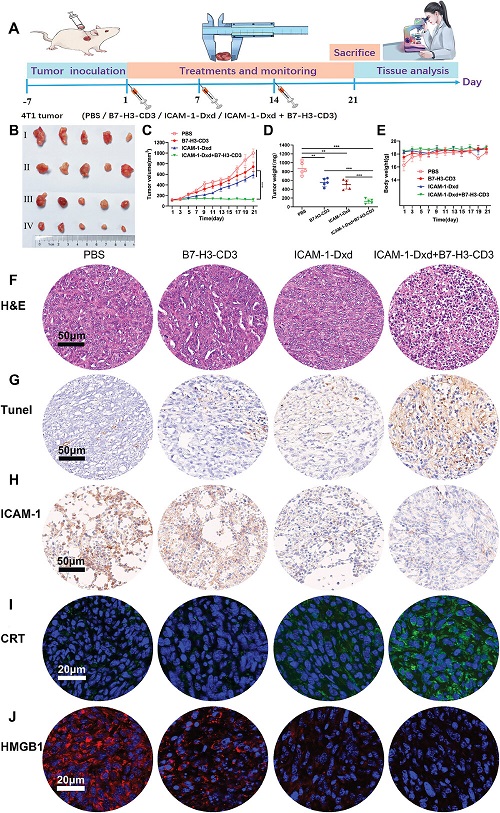
圖3. ICAM-1-Dxd聯(lián)合B7-H3-CD3在體內4T1 TNBC腫瘤模型中的抗腫瘤活性
3.患者來源腫瘤模型(PDX)驗證
在PDX模型中��,聯(lián)合治療同樣表現(xiàn)出優(yōu)異的抗腫瘤活性����,腫瘤體積縮小58%,且未觀察到明顯的全身毒性��。
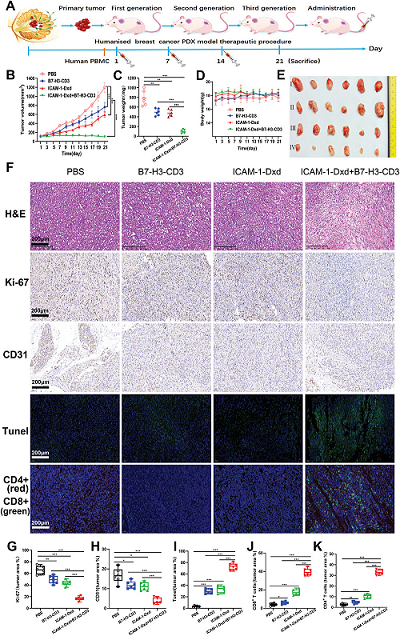
圖4. ICAM-1-Dxd聯(lián)合B7-H3-CD3在TNBC PDX模型中的抗腫瘤活性
三���、創(chuàng)新點與臨床意義
1.協(xié)同作用機制
ICAM-1-Dxd通過直接殺傷腫瘤細胞并誘導ICD�����,為免疫治療提供抗原����;
B7-H3-CD3雙特異性抗體則通過解除免疫抑制�、激活T細胞,增強抗腫瘤免疫應答���。
兩者在重編程TIM方面形成“雙重打擊”��,顯著提高治療效果�����。
2.潛在臨床應用
該聯(lián)合療法不僅適用于TNBC��,還可能擴展至其他ICAM-1高表達的實體瘤(如黑色素瘤����、結腸癌)���。
研究中使用的雙特異性抗體具有高親和力和特異性��,為未來臨床轉化提供了有力支持���。
四、展望
這項研究首次證實了ICAM-1靶向ADC與B7-H3-CD3雙特異性抗體聯(lián)合治療TNBC的協(xié)同效應�����,為克服腫瘤免疫抑制微環(huán)境提供了新策略�。未來需進一步優(yōu)化給藥方案���,并開展臨床試驗驗證其安全性和有效性。
原文鏈接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202415577
本研究的靈魂選手B7-H3-CD3雙特異性抗體工具——InVivoMAb Anti-Mouse CD276/B7-H3 & CD3E Bispecific Antibody正是來自AntibodySystem的產品��!客戶親測好用���!畢竟“抗體選得好���,Paper發(fā)得早”可不是隨便說說的,心動可沖����!
佰樂博生物作為AntibodySystem亞洲獨家代理,將為您的科研工作提供專業(yè)��、全面�����、可靠的試劑產品���。更多產品詳情歡迎致電或者添加產品專員微信咨詢�!

掃碼添加產品專員微信
電話:027-65279366