01
難治性CMV的現(xiàn)狀
在全球每年約20萬(wàn)例成人移植病例中��,CMV感染的發(fā)生率令人擔(dān)憂����。數(shù)據(jù)顯示,實(shí)體器官移植受者的感染發(fā)生率為16-56%����,而造血干細(xì)胞移植受者的感染發(fā)生率則高達(dá)30-70%。具體而言��,49%的異基因造血干細(xì)胞移植患者和21%的實(shí)體器官移植患者術(shù)后會(huì)發(fā)生CMV感染�,經(jīng)治療后��,分別有32%和20%的患者會(huì)進(jìn)展為難治性/耐藥性感染��。值得注意的是�����,CMV肺炎的病死率高達(dá)70%����。據(jù)估算,僅2022年中國(guó)就有約2000余名移植后難治性/耐藥性CMV成人患者����。
傳統(tǒng)治療方案如更昔洛韋�����、纈更昔洛韋�、膦甲酸鈉存在嚴(yán)重局限�����。這些藥物不僅療效有限�,還具有顯著的毒副作用。其中�,(纈)更昔洛韋會(huì)顯著增加骨髓抑制風(fēng)險(xiǎn),而膦甲酸鈉則會(huì)大幅增加腎毒性風(fēng)險(xiǎn)���?�;颊叱R蜻@些不良反應(yīng)而不得不中斷治療�����,顯著影響移植成功率���。
02
馬立巴韋片
在這樣的背景下,馬立巴韋片的問(wèn)世為患者帶來(lái)了新的希望。這種創(chuàng)新型口服抗病毒藥物屬于苯并咪唑核苷類藥物����,是全球首個(gè)靶向并抑制UL97蛋白激酶及其天然底物的抗病毒制劑。其獨(dú)特的三重作用機(jī)制通過(guò)抑制CMV UL97蛋白激酶�����,可以有效抑制病毒DNA的復(fù)制�、衣殼化和核逃逸,從而清除CMV血癥并控制相關(guān)癥狀�。
在TAK-620-303多中心Ⅲ期優(yōu)效性研究中,馬立巴韋展現(xiàn)出顯著的臨床效果�����。研究顯示�,馬立巴韋治療組的病毒清除率達(dá)到55.7%(131/235)��,而常規(guī)治療組僅為23.9%(28/117)��,校正后差異達(dá)32.8%(P<0.001)�。在安全性方面,馬立巴韋組的中性粒細(xì)胞減少發(fā)生率僅為1.7%����,遠(yuǎn)低于傳統(tǒng)治療組的25%��;急性腎損傷發(fā)生率同樣僅為1.7%����,顯著低于膦甲酸鈉組的19.1%�����。
03
專利布局與仿制藥挑戰(zhàn)
馬立巴韋持有多個(gè)專利
包括:

-
制劑專利:涉及馬立巴韋片劑的配方��,包含崩解劑和穩(wěn)定劑等成分。例如���,US20190046625A1(2019年申請(qǐng))保護(hù)了口服固體制劑���,預(yù)計(jì)有效期至 2040 年。
-
制備方法專利:專利如 US20150057245A1(2014年申請(qǐng))�����,涵蓋了合成路線���、關(guān)鍵中間體及純化工藝�,預(yù)計(jì)保護(hù)期至 2034 年左右���。
-
適應(yīng)癥專利:包括針對(duì)耐藥性CMV感染或特定人群(如移植患者)的治療�。例如�,US20170360860A1(2017年申請(qǐng))專門(mén)保護(hù)了治療對(duì)更昔洛韋/纈更昔洛韋耐藥的 CMV 感染����,專利將持續(xù)到 2037 年左右。
仿制藥風(fēng)險(xiǎn)與挑戰(zhàn)
化合物專利到期后��,仿制藥企需規(guī)避制劑與適應(yīng)癥專利風(fēng)險(xiǎn)。原研可能通過(guò)次級(jí)專利(如晶型專利US20210002365A1)延長(zhǎng)保護(hù)����。國(guó)內(nèi)企業(yè)可通過(guò)專利無(wú)效宣告或工藝優(yōu)化突破限制,但需確保不侵犯用途專利�����。
04
市場(chǎng)表現(xiàn)
在市場(chǎng)表現(xiàn)方面�,馬立巴韋的發(fā)展勢(shì)頭強(qiáng)勁。自2021年11月獲FDA批準(zhǔn)上市以來(lái)���,其全球銷售額從2022年的105億日元增長(zhǎng)至2023年的191億日元(約9.62億元人民幣)�。
馬立巴韋片已在美國(guó)�����、歐洲�����、韓國(guó)和澳大利亞獲得孤兒藥資格認(rèn)定����。2021年11月�,馬立巴韋被美國(guó)食品藥品監(jiān)督管理局(FDA)認(rèn)定為首創(chuàng)藥物并獲批上市����;2022年11月,獲得歐盟委員會(huì)(EC)批準(zhǔn)上市�。
在中國(guó),馬立巴韋于2023年12月獲國(guó)家藥品監(jiān)督管理局(NMPA)批準(zhǔn)上市���,并于2024年11月成功納入國(guó)家醫(yī)保乙類目錄����。
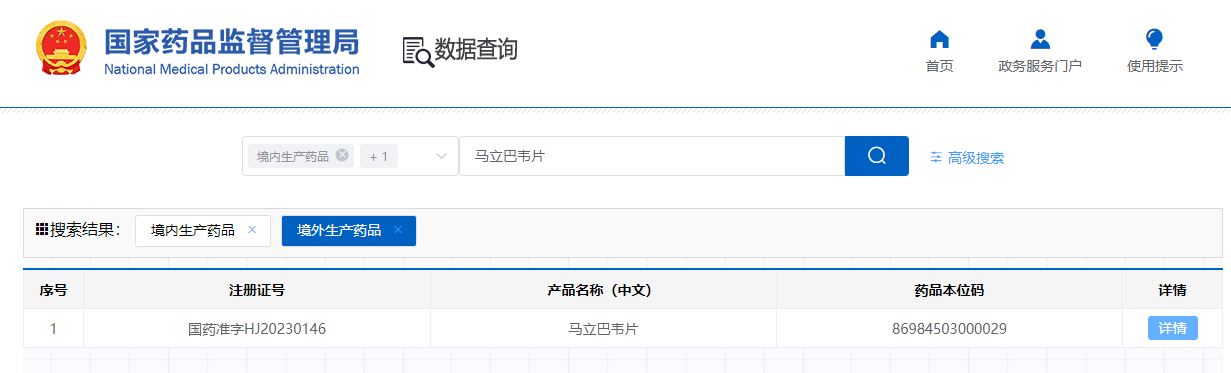
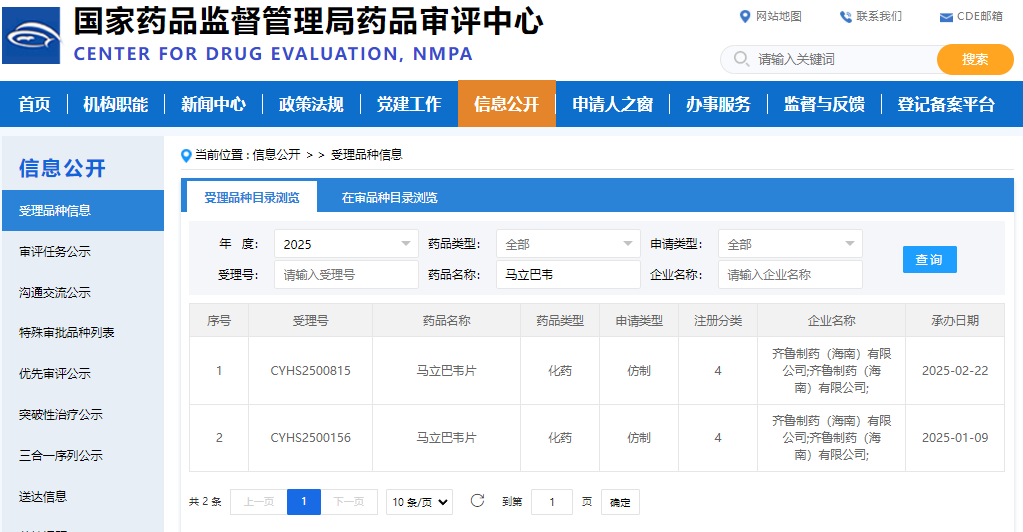
國(guó)內(nèi)仿制藥開(kāi)發(fā)也在積極推進(jìn):2024年12月31日����,奧賽康的4類仿制藥馬立巴韋片上市申請(qǐng)獲得承辦;2025年2月22日��,齊魯制藥(海南)有限公司的4類仿制藥申請(qǐng)獲受理�;此外,桂林南藥也已提交了仿制藥注冊(cè)申請(qǐng)�����。首仿?tīng)?zhēng)奪戰(zhàn)一觸即發(fā)��。
05
臨床突破與未來(lái)展望
馬立巴韋片的問(wèn)世填補(bǔ)了移植后難治/耐藥CMV治療的臨床空白����。這款創(chuàng)新藥物不僅顯著提高了病毒清除率,還大大降低了治療相關(guān)不良反應(yīng)��,已被納入中國(guó)CSCO指南并獲得II級(jí)推薦����。隨著該藥物進(jìn)入醫(yī)保目錄以及國(guó)內(nèi)仿制藥研發(fā)的推進(jìn),預(yù)計(jì)將進(jìn)一步提升藥物可及性����,讓更多患者獲益。馬立巴韋正在改變移植后CMV感染的治療格局��,為提高移植患者的生存率作出重要貢獻(xiàn)��。
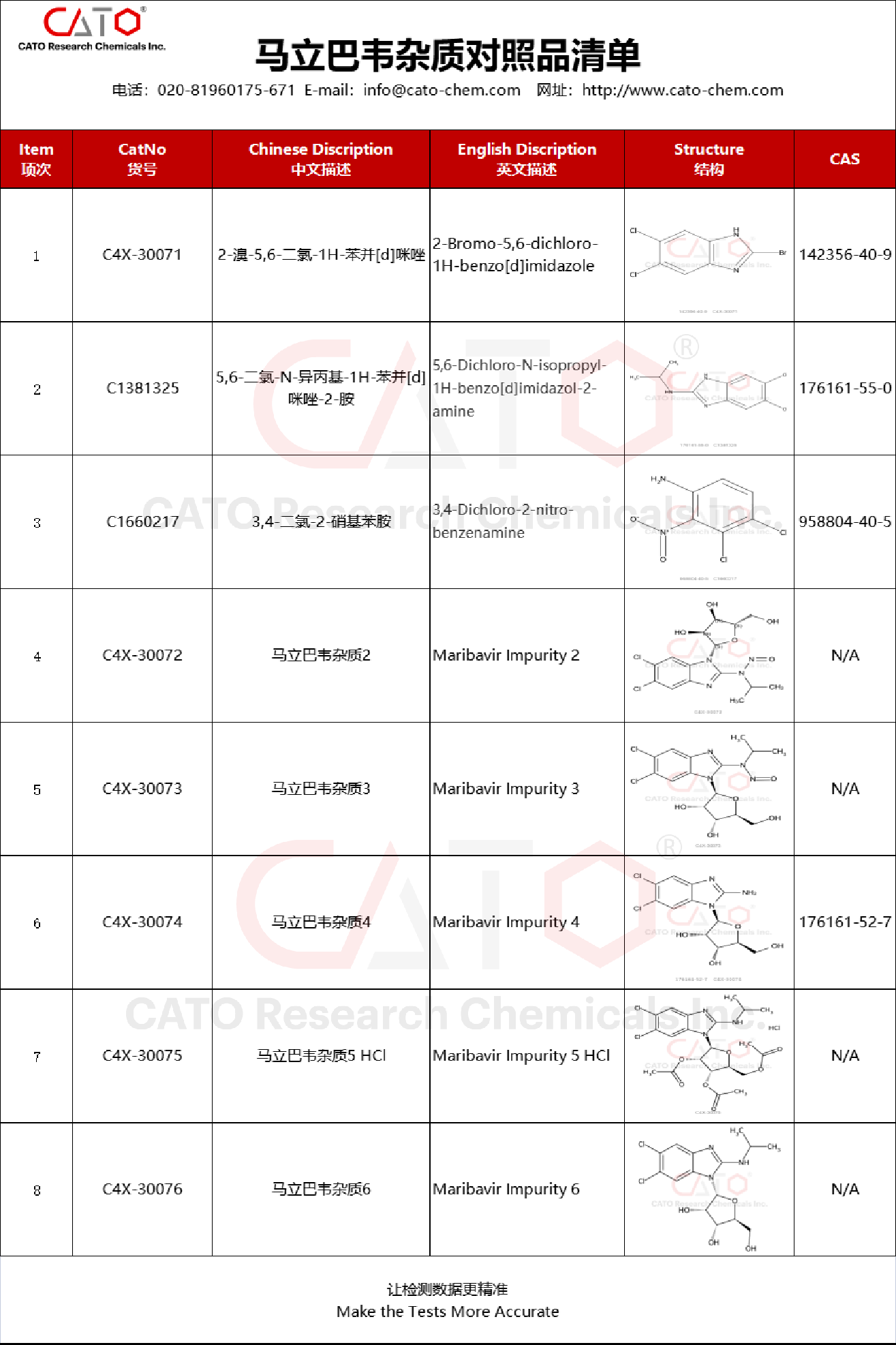
馬立巴韋雜質(zhì)對(duì)照品
為支持馬立巴韋仿制藥的快速發(fā)展���,CATO可提供馬立巴韋雜質(zhì)對(duì)照品�����,助力各研發(fā)機(jī)構(gòu)開(kāi)展仿制藥研究和質(zhì)量控制工作��。