Seamless Cloning Kit (無縫克隆試劑盒)
信裕生物生產(chǎn)的Seamless Cloning Kit(無縫克隆試劑盒)是一種新型的基于插入片段和線性化載體的末端進(jìn)行同源重組的基因克隆試劑盒�����。本試劑盒利用包含了DNA 5' 外切酶(5' Exonuclease)�����、DNA聚合酶(DNA Polymerase)和DNA連接酶(DNA
Ligase)活性的重組酶(assembly enzyme)����,通過同源重組的方法可以將一個(gè)或多個(gè)DNA片段按照預(yù)定方向����、快速�、高效和精確
地插入到線性化載體中�,并且最終構(gòu)建的克隆沒有任何額外的堿基序列,因此被稱作“無縫克隆”���。
和傳統(tǒng)的基因克隆方法相比���,本試劑盒的無縫克隆方法有多方面的突出優(yōu)點(diǎn):(1) 最終構(gòu)建的克隆沒有任何額外的堿基序列,因此是真正的"無縫克隆"��;(2) 可通過一個(gè)反應(yīng)將一個(gè)或多個(gè)片段快速���、定向地插入到載體的任何位置�;(3) 待插入的PCR擴(kuò)增產(chǎn)物無須酶切��;(4) 插入片段的大小范圍寬���,從20bp左右的小片段到10kb左右的大片段都可以成功插入�;(5) 可通過PCR擴(kuò)增獲得線性化載體,因此限制性內(nèi)切酶消化并不是克隆所必須的���;(6) 酶催化的重組連接反應(yīng)非?��?焖俸透咝В瑢?duì)于一個(gè)片段的插入僅需50℃處理15分鐘�����;對(duì)于三個(gè)片段的插入僅需50℃處理30分鐘�,而對(duì)于5個(gè)片段的插入也僅需50℃處理約60分鐘;(7) 只有插入片段和線性化載體的末端才能發(fā)生同源重組�,可以有效避免非特異性的同源重組;(8) 陽(yáng)性克隆比例高��,單個(gè)DNA片段克隆的陽(yáng)性率幾乎為100%�����,三個(gè)片段的克隆陽(yáng)性率約為70-80%��。
本無縫克隆試劑盒操作非常簡(jiǎn)單�����。本試劑盒進(jìn)行基因克隆時(shí)沒有酶切位點(diǎn)的限制,僅需在載體的預(yù)定克隆位點(diǎn)通過酶切進(jìn)行線性化或通過PCR的方法直接制備線性化的載體�����,在插入片段的兩個(gè)PCR引物的5' 端引入與載體克隆位點(diǎn)兩端完全一致的
15~25bp的重疊序列��。重組反應(yīng)可以在50℃快速進(jìn)行�,3-4小時(shí)內(nèi)即可完成從DNA樣品的PCR擴(kuò)增��、純化��、重組���、到轉(zhuǎn)化涂板的全部操作�。其中PCR反應(yīng)約2-3小時(shí)����,PCR產(chǎn)物純化約20分鐘,重組反應(yīng)15分鐘�����,轉(zhuǎn)化涂板約40分鐘,共計(jì)約3-4小時(shí)即可完成�����。
信裕生物無縫克隆試劑盒的工作原理示意圖請(qǐng)參考圖1�����。
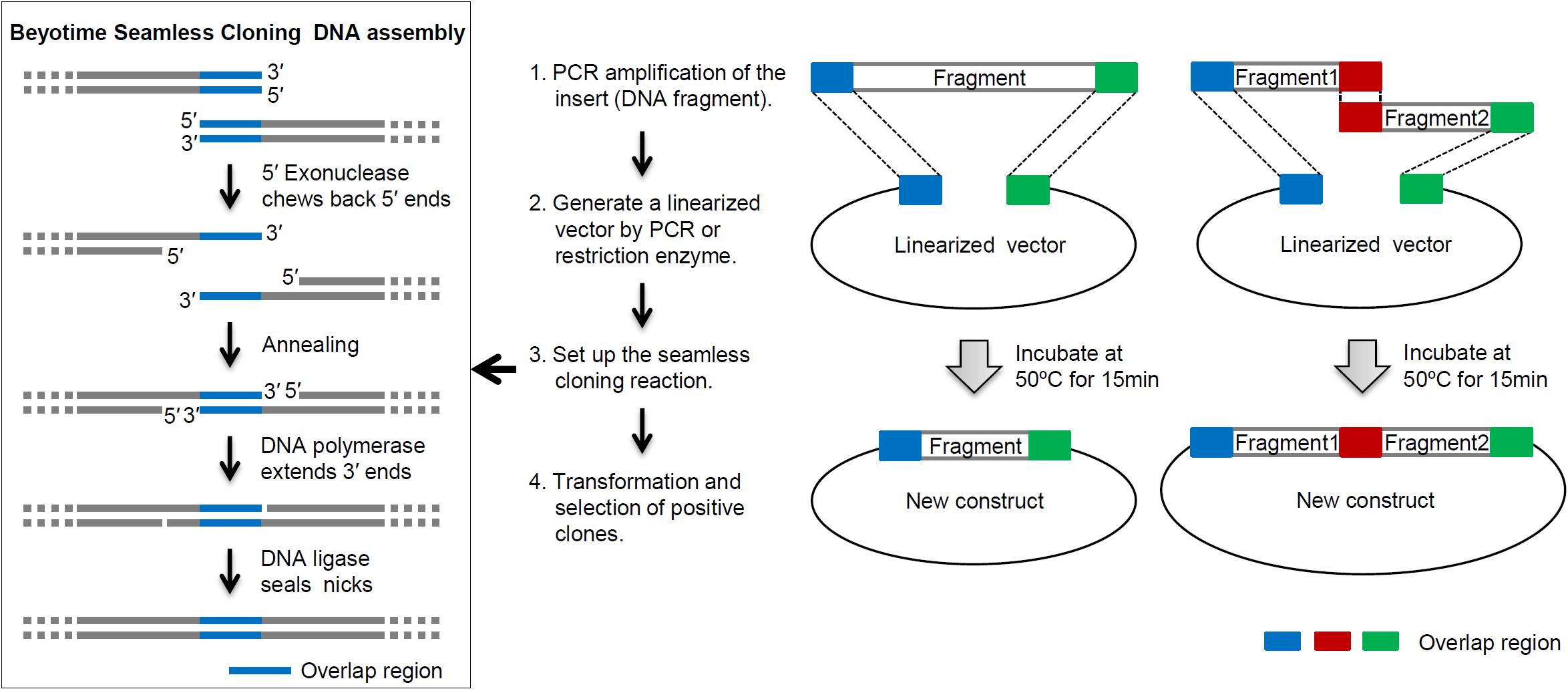
圖1. 信裕生物無縫克隆試劑盒的工作原理圖�����。重疊區(qū)域(overlap region)的DNA序列完全一致��,通常長(zhǎng)度為15-25bp����。不同顏
色的重疊區(qū)域代表不同的重疊序列。在插入2個(gè)或以上片段時(shí)���,不同的重疊序列可以確保待插入片段有序地插入到線性化的載體(linearized vector)中��。
本試劑盒中提供的linearized pUC18為通過EcoRI和BamHI雙酶切制備�。為檢測(cè)本試劑盒的連接效率��,試劑盒還提供了一個(gè)1100bp的DNA fragment, 通過使用pUC18的通用測(cè)序引物(M13 forward sequencing primer (5´-GTAAAACGACGGCCAGT-3´)和M13 reverse sequencing primer (5´-CAGGAAACAGCTATGAC-3´))可對(duì)連接轉(zhuǎn)化后的克隆進(jìn)行菌落PCR擴(kuò)增,擴(kuò)增后得到1300bp的片段的克隆則為陽(yáng)性克隆�����,而擴(kuò)增后得到200bp的片段的克隆則為陰性克隆�����。
本試劑盒用于一個(gè)1100bp片段的克隆和三個(gè)不同的1100bp片段的克隆���,其重組反應(yīng)產(chǎn)物轉(zhuǎn)化DH5α感受態(tài)細(xì)胞后涂板獲得的LB平板的實(shí)測(cè)效果參考圖2A���,菌落PCR鑒定結(jié)果參考圖2B����。
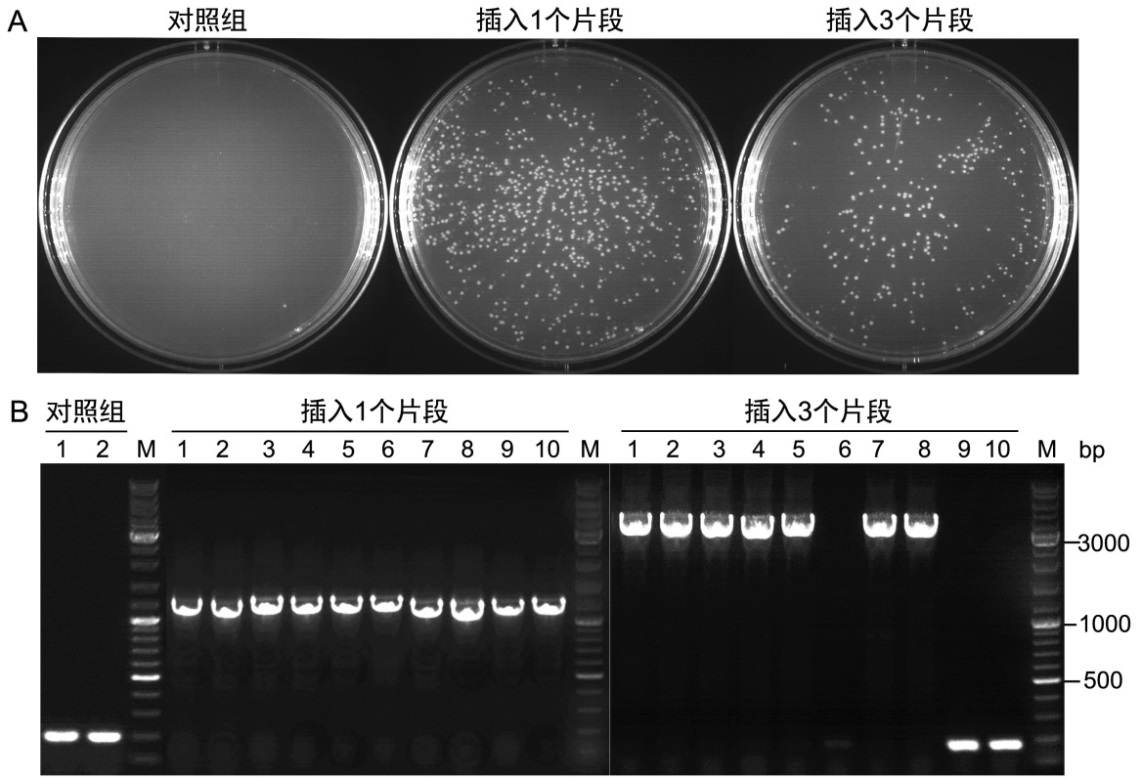
圖2. 本試劑盒用于無縫克隆的實(shí)測(cè)效果。A. 本試劑盒反應(yīng)產(chǎn)物轉(zhuǎn)化感受態(tài)細(xì)菌DH5α后涂板獲得的LB平板效果圖���。在20μl反應(yīng)體系中�,將EcoRI和BamHI雙酶切線性化的載體pUC18 (Linearized pUC18)���,與通過PCR擴(kuò)增的含有重疊序列的插入片段(DNA fragment, 1100bp)混合(pUC18載體與PCR片段的摩爾比為1:3)�;或者與3個(gè)有適當(dāng)重疊序列的不同的1100bp片段混合,pUC18載體與PCR片段的摩爾比為1:1:1:1���,然后加入10μl的2X Seamless Cloning Mix����,并用水補(bǔ)至20μl��,50℃反應(yīng)15min(插入一個(gè)片段)或30min(插入三個(gè)片段)����。反應(yīng)結(jié)束后,將反應(yīng)產(chǎn)物放置在冰上5min�����,取5μl轉(zhuǎn)化到100μl的DH5α感受態(tài)細(xì)菌中�。對(duì)照組中只加入線性化的載體pUC18,同時(shí)也在50℃反應(yīng)15min��。實(shí)驗(yàn)結(jié)果表明�,插入片段數(shù)目越多轉(zhuǎn)化后得到的克隆數(shù)越少。B.菌落PCR鑒定用本試劑盒構(gòu)建得到的克隆�。實(shí)驗(yàn)結(jié)果表明,插入1個(gè)片段時(shí)的陽(yáng)性率基本上為100%�����,插入3個(gè)片段時(shí)的陽(yáng)性率約為70%左右。菌落PCR使用的是pUC18的通用測(cè)序引物M13 forward sequencing primer (5´-GTAAAACGACGGCCAGT-3´)和M13 reverse sequencing primer (5´-CAGGAAACAGCTATGAC-3´)��。
包裝清單:
產(chǎn)品編號(hào)
產(chǎn)品名稱
包裝
XY-7010S-1
2X Seamless Cloning Mix
200μl
XY-7010S-2
Linearized pUC18 (50ng/μl)
10μl
XY-7010S-3
DNA fragment (1100bp, 60ng/μl)
10μl
XY-7010S-4
Nuclease free water
200μl
保存條件:
-20℃保存�,一年有效。
注意事項(xiàng):
單個(gè)片段的PCR產(chǎn)物進(jìn)行重組反應(yīng)時(shí)����,如果PCR條帶單一,可以無須純化并直接進(jìn)行重組反應(yīng)�,但PCR產(chǎn)物的體積不得超過重組反應(yīng)體系的20%,并且重組效率通常會(huì)低于純化后的PCR產(chǎn)物�。
對(duì)于多個(gè)片段的重組反應(yīng),重組效率通常會(huì)低于單個(gè)片段的重組效率�����,建議膠回收純化后再進(jìn)行重組反應(yīng)�����。對(duì)于3個(gè)以上片段的重組反應(yīng)或重組片段大于5kb時(shí)��,強(qiáng)烈建議在膠回收后再進(jìn)行重組反應(yīng)���。通常膠回收后���,重組效率可提高2-10倍。
單片段和線性化載體重組時(shí)��,摩爾比至少為2:1��。多片段和線性化載體重組時(shí)���,各個(gè)片段和線性化載體的摩爾數(shù)宜保持一致�����。
本產(chǎn)品僅限于專業(yè)人員的科學(xué)研究用����,不得用于臨床診斷或治療���,不得用于食品或藥品����,不得存放于普通住宅內(nèi)�。
為了您的安全和健康�����,請(qǐng)穿實(shí)驗(yàn)服并戴一次性手套操作�。
使用說明:
1. 線性化載體的制備
載體的線性化可以在目標(biāo)載體上選擇合適的位點(diǎn)進(jìn)行雙酶切或單酶切��,并對(duì)酶切后的載體進(jìn)行瓊脂糖凝膠電泳和切膠純化(例如信裕生物的D0056, DNA凝膠回收試劑盒)��。也可通過在質(zhì)粒插入位點(diǎn)的左右兩側(cè)設(shè)計(jì)方向相反的引物進(jìn)行PCR�,以獲取線性化載體。PCR擴(kuò)增獲得的線性化載體�,也需要瓊脂糖凝膠電泳和切膠純化。同時(shí)需要注意如下事項(xiàng):
a. 為了降低載體自連背景�,提高陽(yáng)性率,建議采用雙酶切的方法對(duì)載體進(jìn)行線性化��。載體單酶切容易造成載體切割不完全和自連�,導(dǎo)致假陽(yáng)性的產(chǎn)生。
b. 酶切后無論是5' 端突出��、3' 端突出還是平末端都可以用于本試劑盒���,但由于重組過程中會(huì)產(chǎn)生3' 端突出末端,因此酶切后
形成3' 端突出或平末端的假陽(yáng)性率會(huì)更低一些����。
c. 通過酶切獲得線性化載體的情況���,線性化載體上的重疊序列只能用酶切后的3' 端序列進(jìn)行計(jì)算。特別是對(duì)于酶切后產(chǎn)生5' 端突出的情況����,不能以5' 端突出部分計(jì)算重疊序列,因?yàn)橹亟M反應(yīng)時(shí)有DNA 5' 外切酶(5' Exonuclease)活性���,會(huì)消化掉5' 端序列�����。
d. 酶切較長(zhǎng)時(shí)間����,例如酶切3小時(shí)以上或酶切過夜���,可有效降低載體未切開或自連導(dǎo)致的背景�。
e. 通過PCR方法獲得線性化載體時(shí)�����,建議在PCR后使用DpnI (例如信裕生物的D6257)進(jìn)行消化,以消除模板質(zhì)粒對(duì)于后續(xù)獲取重組質(zhì)粒的干擾����。或者在PCR之前宜先通過雙酶切進(jìn)行線性化處理�,以消除模板導(dǎo)致的假陽(yáng)性克隆。
f. PCR擴(kuò)增獲取線性質(zhì)粒時(shí)����,宜使用高保真的DNA聚合酶,例如信裕生物的BeyoFusion™ DNA Polymerase (D7220, D7221)�,BeyoFusion™ DNA Polymerase (D7222, D7222B)或Pfu DNA Polymerase (D7216, D7217)。
2. 待插入片段的制備
a. 如果待插入片段是非常小的片段�,例如20-70bp,可以通過單鏈DNA(常被稱為引物)的合成和退火進(jìn)行制備�����;如果待插入片段的長(zhǎng)度比較長(zhǎng)不能直接進(jìn)行合成��,可以通過PCR擴(kuò)增的方法進(jìn)行制備����。
b. 無論是合成退火還是PCR擴(kuò)增獲得的待插入片段,在其兩側(cè)必須含有15-25bp序列與擬連接的載體或DNA片段完全重疊,后續(xù)重疊區(qū)域會(huì)發(fā)生重組�,從而獲得預(yù)期的重組質(zhì)粒(參考圖1)����。
c. 通過PCR擴(kuò)增獲得待插入片段時(shí),可以在設(shè)計(jì)引物時(shí)在兩條引物的5' 端加上與擬連接的載體或DNA片段上完全重疊的15-25nt的序列�。引物設(shè)計(jì)的要求和普通的引物設(shè)計(jì)要求相同,需要適當(dāng)避免引物自身的二級(jí)結(jié)構(gòu)�、形成引物二聚體和GC含量過高等;并且在引物的5' 端加上15-25nt后��,仍然要求整條序列適當(dāng)避免自身的二級(jí)結(jié)構(gòu)�、二聚體和GC含量過高等。
d. 插入單個(gè)片段的引物設(shè)計(jì)方法可以參考圖3�����。圖3A中給出了常規(guī)的無縫克隆的引物設(shè)計(jì)方法實(shí)例的示意圖��,獲得的克隆完全是無縫的�。圖3B中給出了保留插入位點(diǎn)兩側(cè)酶切位點(diǎn)的引物設(shè)計(jì)方法實(shí)例的示意圖,獲得的重組克隆可以保留兩側(cè)的酶切位點(diǎn)�����,以便于后續(xù)的酶切鑒定或者亞克隆等。
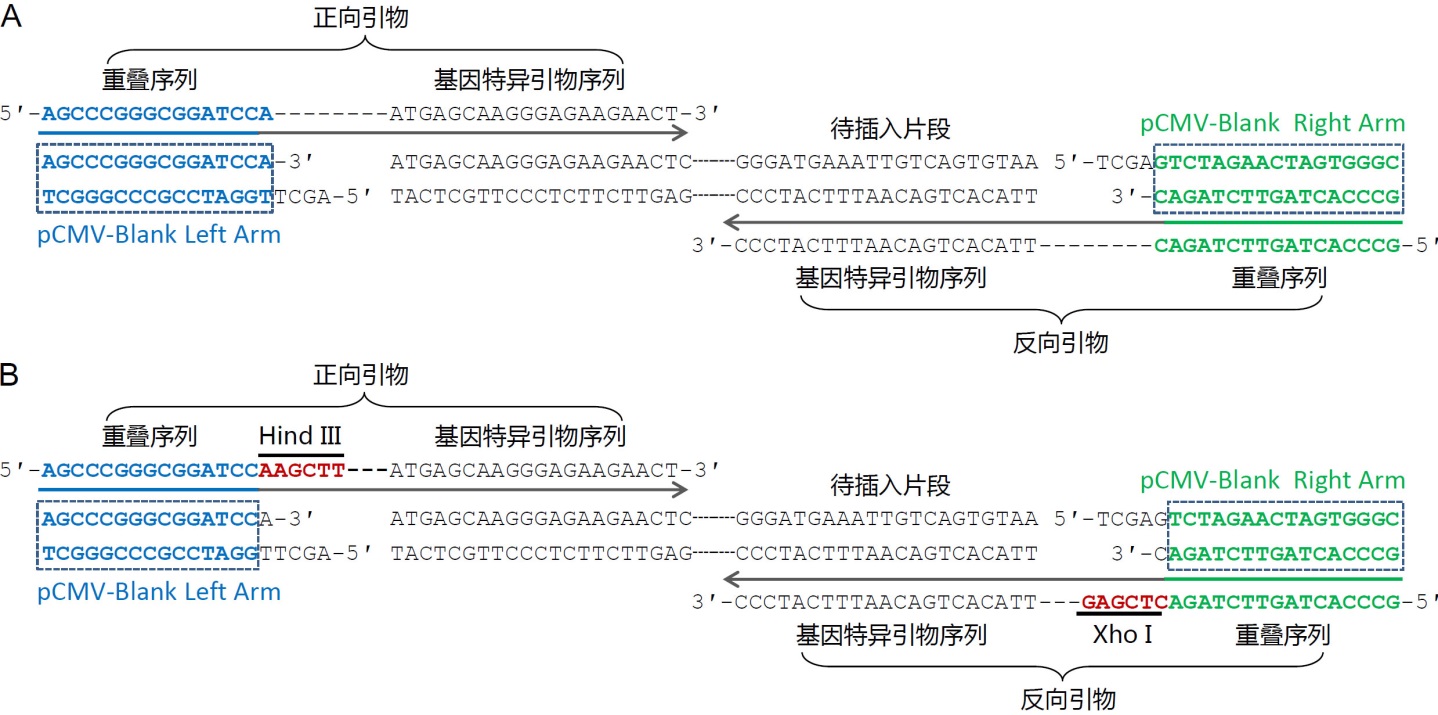
圖3. 使用本試劑盒把單個(gè)片段插入到載體中的引物設(shè)計(jì)實(shí)例示意圖��。A. 目的序列插入到pCMV-Blank (D2602)載體中的無縫克隆引物設(shè)計(jì)示意圖�。pCMV-Blank用HindIII和XhoI雙酶切線性化。選取圖中所示的包含了重疊序列和基因特異引物序列的引物用于PCR擴(kuò)增待插入片段�����,PCR產(chǎn)物切膠回收后與線性化的pCMV-Blank使用本試劑盒進(jìn)行重組反應(yīng)���。B.目的序列插入到pCMV-Blank載體中并保留酶切位點(diǎn)的引物設(shè)計(jì)示意圖�����。pCMV-Blank用HindIII和XhoI雙酶切線性化�����。選取圖中所示的包含了重疊序列����、酶切位點(diǎn)和基因特異引物序列的引物用于PCR擴(kuò)增待插入片段��,PCR產(chǎn)物切膠回收后與線性化的pCMV-Blank使用本試劑盒進(jìn)行重組反應(yīng)��。前者的優(yōu)點(diǎn)在于引物設(shè)計(jì)簡(jiǎn)單,可以實(shí)現(xiàn)無縫克隆�����,后者的優(yōu)點(diǎn)在于多了兩個(gè)酶切位點(diǎn)��,便于后續(xù)的酶切鑒定或亞克隆���。此外,如果計(jì)劃使用本試劑盒把目的片段克隆到信裕生物的pCMV系列質(zhì)粒中���,上圖中的重疊序列可以參考使用����。
e. 插入多個(gè)片段的引物設(shè)計(jì)方法可以參考圖4���。通?��?梢韵攘谐鏊杩寺∑蔚男蛄校瑯?biāo)注出片段之間的相鄰處�,從相鄰處挑選15-20bp作為重疊序列。重疊序列的挑選需要滿足常規(guī)的引物設(shè)計(jì)要求�����,即需要適當(dāng)避免引物自身的二級(jí)結(jié)構(gòu)、形成引物二聚體和GC含量過高等��。重疊序列可以僅在一個(gè)插入片段中(圖4中紅色DNA序列)���,也可以分布在兩個(gè)片段中(下圖中藍(lán)色DNA序列)����。重疊序列宜盡量設(shè)計(jì)為8個(gè)G或C和8個(gè)A或T�����,同時(shí)使退火溫度不低于48℃(以AT配對(duì)為2℃�,GC配對(duì)為4℃進(jìn)行粗略計(jì)算)。隨后利用重疊序列和基因特異的序列來設(shè)計(jì)相應(yīng)的PCR引物��,每個(gè)片段單獨(dú)擴(kuò)增后�,所獲得的PCR產(chǎn)物經(jīng)瓊脂糖凝膠電泳和切膠純化即可用于本試劑盒的重組反應(yīng)。
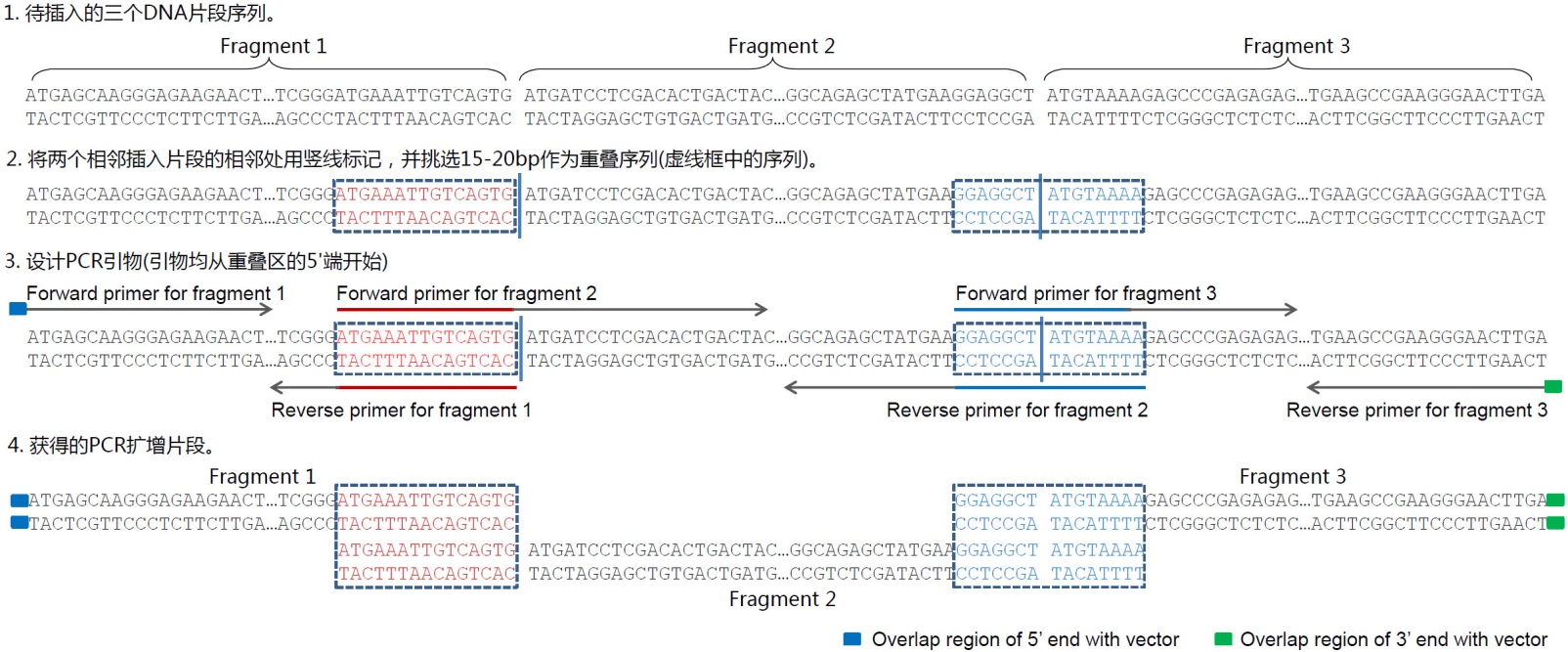
圖4. 使用本試劑盒把3個(gè)片段插入到線性化載體中的引物設(shè)計(jì)實(shí)例示意圖����。如果需要插入更多的片段,可以參考上述實(shí)例示意圖進(jìn)行����。
3. 取出試劑盒的4個(gè)組分��,Nuclease free water置于室溫���,其余置于冰上。參考下表配制如下反應(yīng)體系:
插入片段
1-2個(gè)片段
3-5個(gè)片段
陰性對(duì)照
陽(yáng)性對(duì)照
每個(gè)插入片段與載體的摩爾比
3:1
1:1
-
-
純化的PCR片段
10-100ng
10-100ng
-
1μl DNA fragment (1100bp, 60ng/μl)
線性化載體
50-100ng
50-100ng
50-100ng
1μl Linearized pUC18 (50ng/μl)
2X Seamless Cloning Mix
10μl
10μl
10μl
10μl
Nuclease free water
����?
��?
���?
8μl
a. 當(dāng)插入1-2個(gè)片段時(shí)����,片段和載體的摩爾比為3:1左右時(shí)�����,重組效率最高����。
b. 當(dāng)插入片段小于200bp時(shí)����,建議插入片段和載體的摩爾比為5:1��。
4. 上述反應(yīng)體系置于50℃孵育15 min(插入1-2個(gè)片段)���、30 min(同時(shí)插入3個(gè)片段)或60 min(同時(shí)插入4-5個(gè)片段)���。反應(yīng)完成后如不能立即進(jìn)行后續(xù)操作,可將反應(yīng)樣品保存于-20℃�����。
5. 轉(zhuǎn)化及克隆鑒定�����。
a. 取5μl上一步驟的反應(yīng)樣品加入到50-100μl DH5α等感受態(tài)細(xì)胞中(注意所加入的DNA樣品體積不要超過感受態(tài)體積的1/10)��,輕輕混勻��,將該混合物置于冰上30min�����。
b. 42℃水浴中90秒進(jìn)行熱激,然后迅速放回冰浴中��,靜置3~5min�。
c. 加入500 μl不含抗生素的SOC或LB培養(yǎng)液,輕輕混勻�,37℃震蕩培養(yǎng)1h。
d. 將菌液5000 rpm離心1 min以沉淀菌體���。吸去大部分培養(yǎng)液��,剩余約50-100μl的培養(yǎng)液���,重懸菌體��。然后全部均勻涂布到含
適當(dāng)抗生素的LB平板上�����,37℃培養(yǎng)箱中培養(yǎng)過夜���。
e. 第二天挑取平板上的克隆進(jìn)行菌落PCR或者提取質(zhì)粒進(jìn)行酶切鑒定�����,也可以直接選取數(shù)個(gè)克隆進(jìn)行測(cè)序鑒定��。
常見問題:
1. 轉(zhuǎn)化效率低��,菌落很少甚至沒有
a. 為確保試劑盒正常工作����,請(qǐng)用試劑盒提供的線性化載體和插入片段進(jìn)行對(duì)照實(shí)驗(yàn)。
b. 引物序列設(shè)計(jì)不正確����。檢查引物序列,確保引物兩端有15-25bp的同源臂以用于與相鄰片段進(jìn)行同源組裝���。
c. 感受態(tài)細(xì)胞對(duì)重組反應(yīng)體系過敏���。使用水對(duì)重組后的反應(yīng)液稀釋5-10倍后再進(jìn)行轉(zhuǎn)化。
d. PCR產(chǎn)物不純或插入片段即線性化載體濃度過低�。采用凝膠電泳和膠回收的方法對(duì)PCR產(chǎn)物和線性化載體進(jìn)行純化���,嚴(yán)格按照說明書推薦的摩爾比和濃度進(jìn)行插入片段和線性化載體的混合�����。在20μl總反應(yīng)體系中,插入片段和線性化載體混合后體積應(yīng)盡量小于5μl���,但如果插入片段和線性化載體用水溶解或洗脫的��,體積可以不受此限制����。
e. 轉(zhuǎn)化細(xì)菌時(shí)重組反應(yīng)樣品加入過多��。確保重組反應(yīng)樣品的體積不超過感受態(tài)細(xì)胞體積的10%�。
f. 感受態(tài)細(xì)胞的轉(zhuǎn)化效率過低。用高效率感受態(tài)重新轉(zhuǎn)化��。
g. 選擇了錯(cuò)誤的抗生素���,或在固體LB培養(yǎng)基中加入了過量抗生素�。涂板時(shí)選擇正確的抗生素和濃度��。
2. 陽(yáng)性率過低
a. 載體線性化不完全�����。建議延長(zhǎng)酶切時(shí)間至過夜并凝膠電泳后切膠回收�。
b. 模板質(zhì)粒污染。以質(zhì)粒為模版進(jìn)行PCR擴(kuò)增�,得到的PCR產(chǎn)物經(jīng)過凝膠電泳和切膠純化,這樣可以有效去除模板質(zhì)粒�。使用載體為模板通過PCR擴(kuò)增得到線性化載體時(shí),推薦使用DpnI酶消化以消除模板質(zhì)粒的干擾��。
c. LB平板過期或用平板配制時(shí)使用了錯(cuò)誤的抗生素����,確保使用的LB平板是1個(gè)月內(nèi)配制的,并檢查載體的抗性���。
3. 陽(yáng)性克隆含有錯(cuò)誤的插入片段
PCR產(chǎn)物含有不正確的插入片段�。優(yōu)化PCR反應(yīng)引物設(shè)計(jì)以增加PCR產(chǎn)物的特異性�����,并對(duì)PCR產(chǎn)物進(jìn)行凝膠電泳和切膠純化���。
4. 平板上有很多小菌落
有些外源蛋白的表達(dá)對(duì)大腸桿菌是有毒的�,此時(shí)需要考慮采用低拷貝質(zhì)粒進(jìn)行克隆���。
關(guān)鍵字: Seamless Cloning Kit (無縫克隆試劑盒)說明書��;Seamless Cloning Kit (無縫克隆試劑盒)廠家
上?�?道噬锟萍加邢薰臼且患壹邪l(fā)�、生產(chǎn)、銷售����、服務(wù)于一體的一家生物科技企業(yè),專營(yíng)生化試劑����、標(biāo)準(zhǔn)品、基因�、蛋白、抗體�、Elisa試劑盒、細(xì)胞生物學(xué)�,分子生物學(xué)等高生物產(chǎn)品??偛课挥谏虾#⒃诒本?����、廣東����,江西,吉林等全國(guó)30多個(gè)省市設(shè)有分公司和代理機(jī)構(gòu)��。涉及的產(chǎn)品被中國(guó)科學(xué)院����、清華、北大�����、復(fù)旦�����,上海交大����,復(fù)旦醫(yī)學(xué)院,上海中醫(yī)藥大學(xué)�,華東師范大學(xué),第二軍醫(yī)大學(xué)��,曙光醫(yī)院,浦東新區(qū)人民醫(yī)院等知名科研院所廣泛使用���,可靠而穩(wěn)定的質(zhì)量和完善的售后服務(wù)確��。