湖北源夢(mèng):2月全球新藥研發(fā)進(jìn)展分析報(bào)告:再生元�、柯菲平�����、賽諾菲...
一����、全球新藥2月進(jìn)展概覽
據(jù)全球藥物數(shù)據(jù)庫(kù)統(tǒng)計(jì)����,2023年2月共統(tǒng)計(jì)661個(gè)項(xiàng)目有最新動(dòng)態(tài)���,其中在中國(guó)境內(nèi)進(jìn)入核心臨床及后續(xù)階段的項(xiàng)目共206個(gè)����,在國(guó)內(nèi)項(xiàng)目中占比44.9%�����。(注:最新動(dòng)態(tài)不等同于最新階段���,包括企業(yè)交易��、臨床新適應(yīng)癥�、不同規(guī)格藥品申請(qǐng)上市等����,范圍更廣,臨床申請(qǐng)包括臨床申請(qǐng)以及批準(zhǔn)臨床)
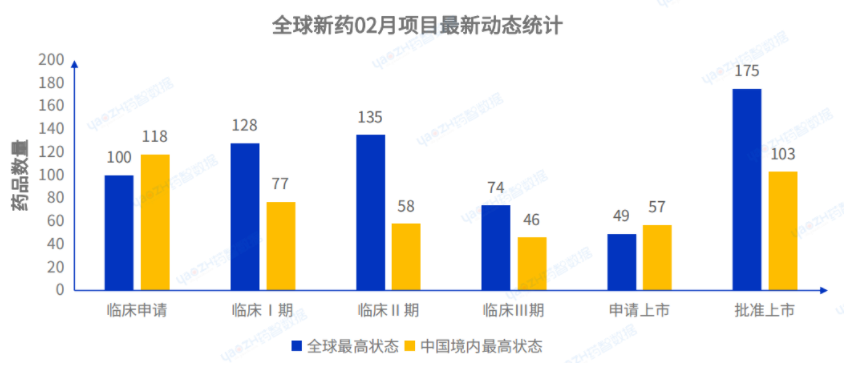
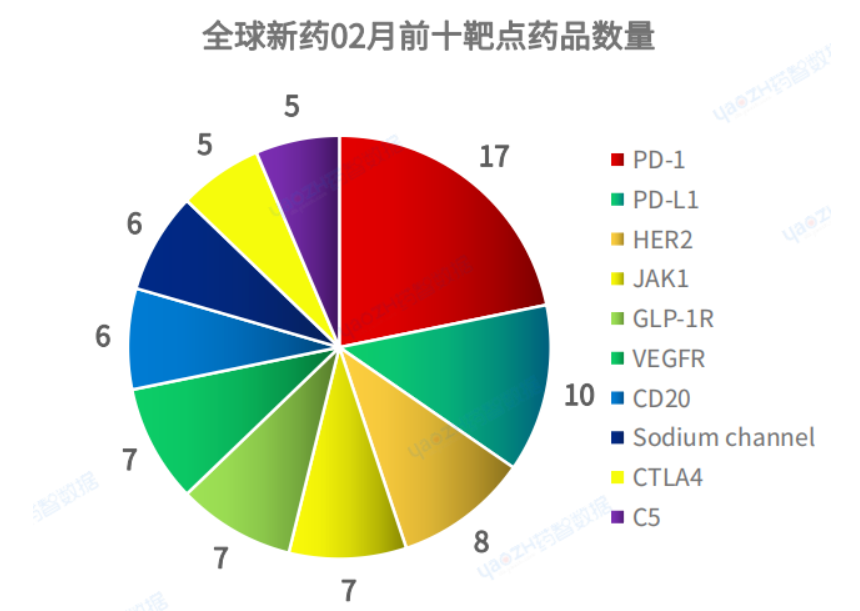
2023年2月全球藥品研發(fā)數(shù)量最多的靶點(diǎn)是PD-1,數(shù)量達(dá)到17個(gè)���,其次是PD-L1以及HER2��,排名前十的靶點(diǎn)如下:
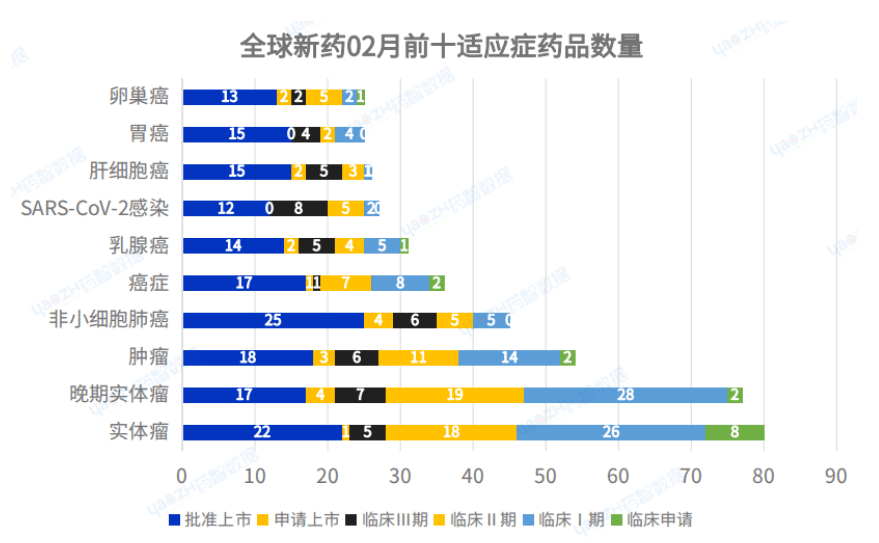
2023年2月全球藥品研發(fā)仍以抗癌藥為主�,數(shù)量最多的適應(yīng)癥是實(shí)體瘤�,其次是晚期實(shí)體瘤,排名前十的適應(yīng)癥如下:
二����、全球新藥2023年2月重點(diǎn)項(xiàng)目
1、Omaveloxolone:全球首款Friedreich共濟(jì)失調(diào)癥治療藥物獲FDA批準(zhǔn)上市
2023年2月28日�,Reata Pharmaceuticals Inc宣布��,F(xiàn)DA已經(jīng)批準(zhǔn)Nrf2激動(dòng)劑Skyclarys(Omaveloxolone)的新藥申請(qǐng)��,用于治療16歲以上弗里德賴希共濟(jì)失調(diào)癥(Friedreich’s Ataxia����,F(xiàn)A)患者。
omaveloxolone是FDA批準(zhǔn)的種也是唯一一種適用于弗里德賴希共濟(jì)失調(diào)患者的藥物���,這種無(wú)藥可治的疾病�����,終于迎來(lái)首款療法��。
弗里德賴希共濟(jì)失調(diào)癥(Friedreich’s Ataxia)是一個(gè)常染色體隱性障礙涉及三核苷酸重復(fù)擴(kuò)增導(dǎo)致進(jìn)行性神經(jīng)變性��。它會(huì)影響多個(gè)脊髓束��,導(dǎo)致肌肉無(wú)力和四肢協(xié)調(diào)性受損��。童年時(shí)期步態(tài)蹣跚是由此產(chǎn)生的主要癥狀�����。其他特征包括骨骼異常����,心肌病和糖尿病。
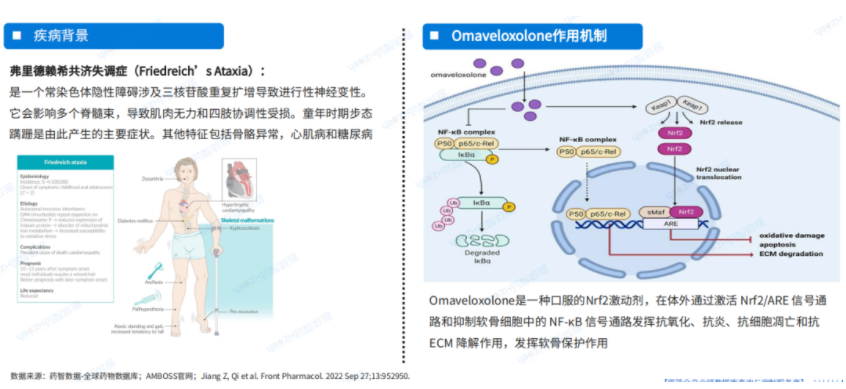
Omaveloxolone是一種口服的Nrf2激動(dòng)劑�����,在體外通過(guò)激活 Nrf2/ARE 信號(hào)通路和抑制軟骨細(xì)胞中的 NF-κB 信號(hào)通路發(fā)揮抗氧化����、抗炎�、抗細(xì)胞凋亡和抗ECM 降解作用�,發(fā)揮軟骨保護(hù)作用。
2��、Efanesoctocog alfa:全球首款每周1次血友病A療法獲FDA批準(zhǔn)上市
2023年2月23日�����,賽諾菲宣布�����,F(xiàn)DA已批準(zhǔn)A型血友病治療藥物efanesoctocog alfa的生物制品許可申請(qǐng)(BLA)����,這是一種first-in-class高持續(xù)性的凝血因子VIII替代療法,為全球首款治療A型血友病一周一次藥物����。
Efanesoctocog alfa獲批基于一項(xiàng)開放標(biāo)簽�����、多中心的III期研究(XTEND-1)���。
試驗(yàn)設(shè)計(jì):A組即預(yù)防組(n=133)成員每周給予50 IU/kg Efanesoctocog alfa��,持續(xù)52 周����;B組即按需組(n=26)成員最初根據(jù)需要給予50 IU/kg,持續(xù) 26 周����,之后變成每周一次給藥,持續(xù) 26 周����。
試驗(yàn)終點(diǎn):
1. 在每周接受一次efanesoctocogalfa預(yù)防性治療的A組患者中,52周內(nèi)中位年出血率(ABR)為0�����,平均ABR為0.70��,達(dá)到了具有臨床意義的出血預(yù)防的主要終點(diǎn)
2. 每周一次的 efanesoctocog alfa預(yù)防具有良好的耐受性��,與之前的預(yù)防相比提供了更好的出血保護(hù)�,在一周的大部分時(shí)間提供了正常至接近正常水平的高持續(xù)因子活性 (>40%),在第 7 天提供了>10%�����。
3、Sparsentan:首個(gè)IgA腎病非免疫抑制療法獲FDA批準(zhǔn)上市
2023年2月17日�,Travere Therapeutics, Inc.宣布,F(xiàn)DA已加速批準(zhǔn) FILSPARI™(sparsentan)用于治療IgA腎病��。
Sparsentan是個(gè)單分子雙重內(nèi)皮素血管緊張素受體拮抗劑(DEARA)獲批用于IgA 腎病患者����,這是個(gè)也是唯一一個(gè)用于減少 IgA 腎病蛋白尿的非免疫抑制療法。
Sparsentan可靶向阻斷內(nèi)皮素A受體(ETA)和血管緊張素II亞型1受體通路(Ang II)�,有利于保護(hù)腎小球足細(xì)胞,防止腎小球硬化和系膜細(xì)胞增生以減少蛋白尿����。
Sparsentan的獲批基于III期 PROTECT 研究的正面頂線中期結(jié)果,這也是IgAN領(lǐng)域迄今為止規(guī)模的干預(yù)性研究���。PROTECT研究達(dá)到了具有統(tǒng)計(jì)學(xué)意義的預(yù)先指定的中期主要療效終點(diǎn)�,治療36周后�,接受sparsentan的患者蛋白尿從基線平均減少49.8%,而接受厄貝沙坦治療的患者蛋白尿從基線平均減少15.1%(p<0.0001)��。
4�、Pegcetacoplan:全球首款治療地圖樣萎縮(GA)獲FDA批準(zhǔn)上市
2023年2月17日,Apellis宣布����,F(xiàn)DA批準(zhǔn)其補(bǔ)體C3環(huán)肽抑制劑Pegcetacoplan上市,用于治療繼發(fā)于年齡相關(guān)性黃斑變性(AMD)的地圖樣萎縮(GA)�����,這是首款針對(duì)GA適應(yīng)癥的上市藥物�。
地圖樣萎縮(GA)是年齡相關(guān)性黃斑變性(AMD)的一種晚期形式,因感光器����、視網(wǎng)膜色素上皮 (RPE) 和下方脈絡(luò)膜毛細(xì)血管的喪失所致,可導(dǎo)致視覺(jué)功能進(jìn)行性和不可逆轉(zhuǎn)喪失�,在此之前,全球尚未批準(zhǔn)用于治療GA的藥物��。
補(bǔ)體系統(tǒng)三大途徑:經(jīng)典途徑�、替代途徑、凝集素途徑�。補(bǔ)體過(guò)度激活導(dǎo)致 GA 不可逆的病理性生長(zhǎng),而 C3 是精確控制補(bǔ)體過(guò)度激活的唯一目標(biāo)�。
Pegcetacoplan由兩個(gè)共價(jià)結(jié)合到40 kDa 線性 PEG 聚合物兩端的 15 個(gè)氨基酸環(huán)肽組成,可與聚乙二醇聚合物結(jié)合���,并特異性結(jié)合 C3 和 C3b����,旨在調(diào)節(jié)補(bǔ)體級(jí)聯(lián)的過(guò)度激活。

5����、鹽酸凱普拉生:首款國(guó)產(chǎn)自研P-CAB創(chuàng)新藥獲批上市
2023年2月14日,國(guó)家藥品監(jiān)督管理局批準(zhǔn)江蘇柯菲平醫(yī)藥股份有限公司申報(bào)的1類創(chuàng)新藥鹽酸凱普拉生片上市���,該藥品適用于十二指腸潰瘍和反流性食管炎的治療���,為首款國(guó)產(chǎn)自研P-CAB創(chuàng)新藥。
鹽酸凱普拉生是一種新型鉀離子競(jìng)爭(zhēng)性酸阻滯劑(P-CAB)��,通過(guò)與H+-K+-ATP酶上的K+結(jié)合位點(diǎn)結(jié)合���,抑制胃酸分泌��。該藥品的上市為十二指腸潰瘍和反流性食管炎患者提供了新的治療選擇��。
國(guó)內(nèi)P-CAB藥物競(jìng)爭(zhēng)格局
截至目前�,國(guó)內(nèi)共有三款P-CAB類藥物上市,分別為武田的富馬酸伏諾拉生片����、羅欣藥業(yè)替戈拉生片�����,和柯菲平的凱普拉生片���,其中前兩款都已納入醫(yī)保��。此外�,上海醫(yī)藥�、揚(yáng)子江藥業(yè)也布局了P-CAB藥物研發(fā),未來(lái)競(jìng)爭(zhēng)可見(jiàn)一斑�����。
2022 年 9 月�����,復(fù)星醫(yī)藥與柯菲平醫(yī)藥簽署許可協(xié)議:
1. 雙方將聯(lián)合開發(fā)包括鹽酸凱普拉生口服制劑和普通注射劑的所有可用適應(yīng)癥
2. 在中國(guó)地區(qū)�����,柯菲平醫(yī)藥作為合作產(chǎn)品的上市許可持有人,復(fù)星醫(yī)藥產(chǎn)業(yè)享有獨(dú)家商業(yè)化權(quán)利�����,包括市場(chǎng)推廣����、經(jīng)銷等
3. 在中國(guó)以外區(qū)域,復(fù)星醫(yī)藥產(chǎn)業(yè)作為合作產(chǎn)品的上市許可持有人���,享有獨(dú)家產(chǎn)品權(quán)利����,包括但不限于臨床研究���、注冊(cè)����、商業(yè)化��、再授權(quán)等
6��、EYLEA(阿柏西普):首款ROP治療藥物獲FDA批準(zhǔn)上市
2023年2月8日,再生元制藥公司今天宣布�����,F(xiàn)DA已批準(zhǔn) EYLEA ®(阿柏西普)注射液用于治療患有早產(chǎn)兒視網(wǎng)膜病變 (ROP) 的早產(chǎn)兒����。在首次獲得兒科批準(zhǔn)后��,EYLEA 現(xiàn)在被用于治療由眼部血管生成引起的五種視網(wǎng)膜疾病��。
EYLEA ®是FDA批準(zhǔn)的首款ROP治療藥物�,在此之前,F(xiàn)DA批準(zhǔn)的唯一常用治療ROP方法是激光光凝手術(shù)�。
截止目前,Eylea已被批準(zhǔn)用于治療由眼部血管生成引起的5種視網(wǎng)膜疾?�。?/p>
2022年度全球暢銷藥TOP10中�,Eylea為再生元和拜耳帶來(lái)96.47億美元的收入,擠進(jìn)全球暢銷藥TOP10榜單位居第10位����。
該ROP適應(yīng)癥的批準(zhǔn)是基于兩項(xiàng)全球III期試驗(yàn)的數(shù)據(jù),即FIREFLEYE和BUTTERFLEYE——研究 EYLEA 0.4 mg 與 ROP 嬰兒的激光光凝���。在這兩項(xiàng)試驗(yàn)中���,大約 80% 的接受 EYLEA 治療的嬰兒在 52 周齡時(shí)實(shí)現(xiàn)了既沒(méi)有活躍的 ROP 也沒(méi)有不利的結(jié)構(gòu)結(jié)果����,這比沒(méi)有治療的預(yù)期要好��。
7�����、Nirogacestat:全球首個(gè)治療硬纖維瘤癌癥新藥申請(qǐng)上市
2023年2月28日�,SpringWorks Therapeutics宣布,F(xiàn)DA接受其口服特異性γ-分泌酶小分子抑制劑nirogacestat的新藥申請(qǐng)�,若成功獲批,將成為全球首款用以治療硬纖維瘤的癌癥新藥����。
硬纖維瘤是一種失能性并可導(dǎo)致毀容的罕見(jiàn)軟組織腫瘤。硬纖維瘤的治療方法為手術(shù)切除�����,然而在手術(shù)切除后腫瘤復(fù)發(fā)率非常高���,導(dǎo)致療效不佳����。目前沒(méi)有獲批療法治療硬纖維瘤。
Nirogacestat作用機(jī)制(γ-secretase)
γ-分泌酶能夠切割多種跨膜蛋白復(fù)合體���,其中包括Notch蛋白�����,而Notch蛋白被認(rèn)為能夠激活導(dǎo)致硬纖維瘤生長(zhǎng)的信號(hào)通路。
γ-分泌酶已顯示可裂解 BCMA��,BCMA 是一種在多發(fā)性骨髓瘤細(xì)胞上特異性表達(dá)的治療靶點(diǎn)�����。SpringWorks正在與行業(yè)領(lǐng)先的 BCMA 治療開發(fā)商合作���,將 nirogacestat 作為跨模式多發(fā)性骨髓瘤聯(lián)合治療的潛在基石�����。
硬纖維瘤適應(yīng)癥競(jìng)爭(zhēng)格局
據(jù)全球藥物數(shù)據(jù)庫(kù)統(tǒng)計(jì)����,目前在全球范圍內(nèi),僅有nirogacestat有望批準(zhǔn)上市用于硬纖維瘤的治療���,且針對(duì)該罕見(jiàn)病研究較為稀缺�����,在中國(guó)范圍內(nèi)目前未有相關(guān)報(bào)道�,市場(chǎng)潛力巨大��,有望為硬纖維瘤患者的治療提供一個(gè)更優(yōu)的選擇�。
8、FB2001(Bofutrelvir):前沿生物加速推進(jìn)抗新冠藥物II/III期臨床
2023年2月6日����,中國(guó)小核酸領(lǐng)軍企業(yè)蘇州瑞博生物技術(shù)股份有限公司(簡(jiǎn)稱“瑞博生物“)宣布,瑞博生物自主研發(fā)的抗血栓小核酸藥物(RBD4059注射液)已在澳大利亞獲得HREC批準(zhǔn)�,將于近日啟動(dòng)首次人體臨床試驗(yàn)。
RBD4059是瑞博生物基于具有自主知識(shí)產(chǎn)權(quán)的RIBO-GalSTAR®肝靶向技術(shù)平臺(tái)獨(dú)立開發(fā)并擁有全球權(quán)益的一種GalNAc偶聯(lián)siRNA藥物����,也是全球首個(gè)進(jìn)入臨床針對(duì)FXI靶點(diǎn)的該類藥物。
9��、GR2002:全球首款TSLP雙抗申請(qǐng)臨床
2023年02月14日,智翔金泰開發(fā)的胸腺基質(zhì)淋巴生成素(TSLP)雙抗GR2002在國(guó)內(nèi)申報(bào)臨床���,這是全球首款申請(qǐng)臨床的TSLP雙抗�。
TSLP是炎癥級(jí)聯(lián)反應(yīng)的啟動(dòng)因子之一�,與特應(yīng)性皮炎、哮喘�、慢性阻塞性肺疾病等過(guò)敏性疾病的發(fā)生密切相關(guān),是目前唯一被證明對(duì)低Th2型哮喘有效的靶點(diǎn)��。
TSLP同靶點(diǎn)競(jìng)爭(zhēng)格局
據(jù)全球藥物數(shù)據(jù)庫(kù)統(tǒng)計(jì)�,目前同TSLP靶點(diǎn)藥物共11個(gè),其中包括1個(gè)上市藥物���,進(jìn)入臨床階段有9個(gè)藥物,臨床申請(qǐng)1個(gè)�。
目前,全球僅一款TSLP靶向藥物tezepelumab上市���,2022年全球銷售額為1.74億美元�,期待能有更多的藥物進(jìn)入這個(gè)市場(chǎng)�����,為更多的患者提供不同的治療方案。