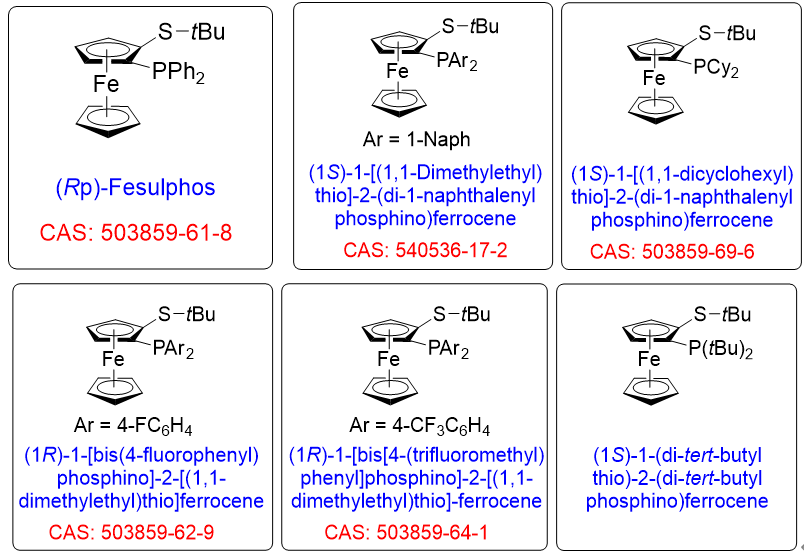
2003年西班牙馬德里自治大學Carretero教授開發(fā)了一種合成具有面手性光學純1-膦基-2-硫基二茂鐵配體的方法�。從光學純的叔丁基亞磺酰基二茂鐵(R)-2a出發(fā)���,在強堿的作用下發(fā)生鄰位鋰化反應�,得到的鋰試劑物種與多種碳及雜芳環(huán)親電試劑制備了光學純的1,2-二取代二茂鐵化合物(圖1)(J. Org. Chem. 2003, 68, 3679-3686)��。其中1-膦基-2-硫基二茂鐵配體被命名為Fesulphos配體���。由于Fesulphos配體中膦、硫原子均能與金屬中心配位�����,特殊的二茂鐵空間結(jié)構(gòu)營造了一個獨特的手性環(huán)境���,在一系列金屬催化的不對稱反應中(如:雜Diels-Alder反應��、環(huán)氧/氮化合物的開環(huán)反應���、Mannich反應以及1,3-偶極環(huán)加成)表現(xiàn)出優(yōu)異的反應活性和對映選擇性����。

圖1
1�����、雜Diels-Alder反應
富電子二烯與醛亞胺的催化對映選擇性雜Diels-Alder反應是構(gòu)建高光學純六元氮雜環(huán)的重要策略��。2004年Carretero教授利用Cu(I)/Fesulphos絡合物為催化劑����,AgClO4作為鹵素攫取劑,在室溫條件下���,Danishefsky二烯與N-磺酰醛亞胺發(fā)生雜Diels-Alder反應��,以高達>99.5%ee(一次重結(jié)晶)���、90%收率獲得了[4+2]環(huán)加成產(chǎn)物:N-磺酰基二氫吡啶酮��。該方法操作簡單����、條件反應溫和���,有很強的實用性。相關(guān)成果發(fā)表在J. Am. Chem. Soc. 2004, 126, 456-457上(圖2)�����。
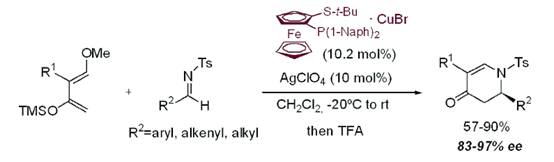
圖2
2�����、環(huán)氧/氮化合物開環(huán)反應
鈀催化的不對稱meso-氧雙環(huán)和氮雜雙環(huán)烯烴與二烷基鋅試劑的親核烷基化開環(huán)反應是一種重要的合成方法��。除了常用的t-Bu-PHOX�,Tol-BINAP,MeOBiphep�,QuinoxP*手性配體,Fesulphos配體也被開發(fā)應用于這類反應���。2005年Carretero小組選用穩(wěn)定的[(Fesulphos)Pd(Me)(PhCN)]+ X-作為催化劑�����,且催化劑負載量低至0.5mol%足以實現(xiàn)高收率�、高對映選擇性的開環(huán)反應��。雙環(huán)底物和二烷基鋅試劑均具有良好的底物普適性����,Fesulphos配體獨特的空間結(jié)構(gòu)和電子性能在反應關(guān)鍵的碳鈀化過程中提供了高度的不對稱誘導效應���。相關(guān)成果發(fā)表在J. Am. Chem. Soc. 2005, 127, 17938-17947上(圖3)�。
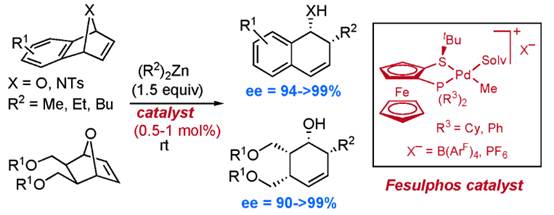
圖3
3�、1,3-偶極環(huán)加成反應
五元雜環(huán)是藥物化學中的關(guān)鍵單元和極具價值的合成砌塊,不對稱催化1,3-偶極環(huán)加成反應是一種非常強大的五元雜環(huán)構(gòu)建策略����,為構(gòu)建結(jié)構(gòu)復雜的各種有機雜環(huán)提供了高效且原子經(jīng)濟性的合成方法���。
1)銅催化的1,3-偶極環(huán)加成反應
西班牙馬德里自治大學Carretero教授一直致力于對映選擇性1,3-偶極環(huán)加成反應的研究��。2005年報道了Cu(I)/Fesulphos催化體系在亞甲胺葉立德與馬來酰亞胺的1,3-偶極環(huán)加成反應中表現(xiàn)出非常好的活性和對映選擇性。利用該策略�����,僅需要0.5-3mol%的催化載量�����,即可合成一系列吡咯烷衍生物(up to endo/exo >98:2;ee >99%)�。相關(guān)成果發(fā)表在J. Am. Chem. Soc. 2005, 127, 16394-16395上(圖4)�。2008年該小組利用Cu(I)/Fesulphos催化體系實現(xiàn)了市售的反式1,2-二苯磺?�;蚁┡c亞甲胺葉立德的1,3-偶極環(huán)加成反應��,隨后通過兩個磺?����;倪€原消除得到含有兩個手性中心的吡咯啉衍生物���。為了顯示該方法的應用價值����,作者通過分子后期結(jié)構(gòu)修飾合成了藥物分子Schramm’s C-azanucleoside����。相關(guān)成果發(fā)表在J. Am. Chem. Soc. 2008, 130, 10084-10085上(圖5)��。
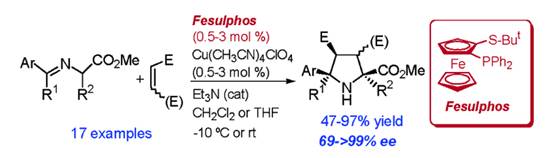
圖4
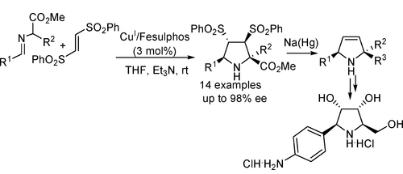
圖5
2009年該小組證明了α,β-不飽和酮也是1,3-偶極環(huán)加成反應中的有效親偶極子�,依賴于Cu(I)/Fesulphos催化體系2-環(huán)戊烯酮與亞甲胺葉立德順利地發(fā)生環(huán)加成反應構(gòu)筑了endo-選擇性的雙環(huán)吡咯烷衍生物(85-95%ee),而在該催化體系下六元環(huán)狀烯酮僅能以<10%的轉(zhuǎn)化率轉(zhuǎn)化為相應的環(huán)化產(chǎn)物�����。該反應同樣適用于非環(huán)狀的烯酮底物���,反式的α,β-不飽和酮給出了exo-為主的環(huán)加成產(chǎn)物��,再一次證明了反應的endo/exo選擇性與烯酮的順�、反構(gòu)型高度相關(guān)�。相關(guān)成果發(fā)表在Org. Lett. 2009, 11, 393-396上(圖6)。
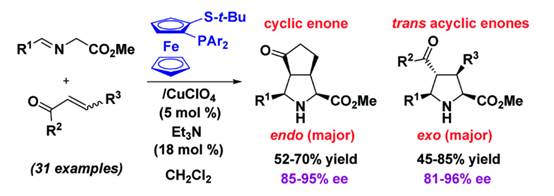
圖6
2024年Carretero小組報道了一種高效制備軸手性2-萘基吡咯化合物的合成方法�。該方法使用Cu(I)/Fesulphos催化體系實現(xiàn)了高對映選擇性亞甲胺葉立德與缺電子烯烴的1,3-偶極環(huán)加成反應,隨后通過吡咯烷烷基化以及DDQ/藍光介導的氧化芳構(gòu)化過程構(gòu)筑C-C軸手性2-萘基吡咯化合物���。這一策略有效地實現(xiàn)了中心手性到軸手性的轉(zhuǎn)化���。相關(guān)成果發(fā)表在Org. Lett. 2024, 26, 922−927上(圖7)。
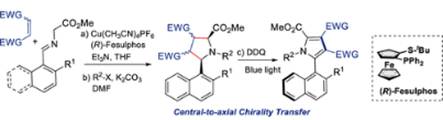
圖7
2)銀催化的1,3-偶極環(huán)加成反應
2016年Carretero小組報道了烯基芳烴作為親偶極子參與的不對稱1,3-偶極環(huán)加成反應。在CuI/(R)-DTBM-Segphos催化下���,適度活化的烯烴與亞甲胺葉立德反應獲得exo-型4-芳基脯氨酸衍生物���;在AgI/(R)-Fesulphos催化下,該反應獲得endo-型為主的4-芳基脯氨酸衍生物���。該反應體系也適用于二烯類底物�����,硝基的吸電子效應沿著1,3-二烯有效地傳遞到親偶極體的末端位置�����,發(fā)生區(qū)域選擇性環(huán)加成反應�����,合成exo-環(huán)加成產(chǎn)物����。相關(guān)成果發(fā)表在Angew. Chem. Int. Ed. 2016, 55, 15334-15338上(圖8)����。
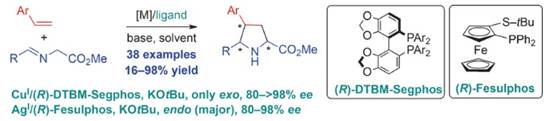
圖8
2019年Chowdhury小組首次將β-硅基亞甲基丙二酸酯作為親偶極體引入亞甲胺葉立德參與的1,3-偶極環(huán)加成反應中,Ag(I)-Fesulphos催化體系在這一反應中表現(xiàn)出優(yōu)異的非對映選擇性和對映選擇性���,得到具有多個連續(xù)手性中心的3-硅基吡咯啉衍生物(收率高達81%�,dr高達95:5�,er高達96:4)。環(huán)加成產(chǎn)物可以通過兩步反應方便地轉(zhuǎn)化為3-羥基脯氨酸衍生物�����,證明了該方法的實用性�。相關(guān)成果發(fā)表在J. Org. Chem. 2019, 84, 2404-2414上(圖9)。
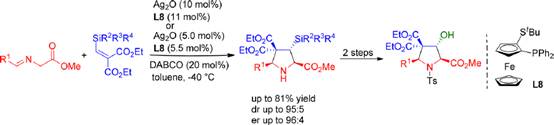
圖9
2021年Antonchick和Waldmann小組開發(fā)了一種立體發(fā)散性串聯(lián)合成方法��,該方法通過兩個連續(xù)的AgOAc/(R)-Fesulphos催化的亞甲胺葉立德與a’-亞烷基-2-環(huán)戊烯酮的1,3-偶極環(huán)加成反應����,在熱力學控制的平衡過程中產(chǎn)生具有八個高非對映和對映選擇性立體中心的雙環(huán)加成化合物。作者發(fā)現(xiàn)水相體系(THF:H2O)能夠?qū)崿F(xiàn)非立體選擇性的改變���,獲得endo,exo構(gòu)型的主產(chǎn)物��;相反在DCM體系中�,則獲得熱力學穩(wěn)定的endo,endo構(gòu)型產(chǎn)物。這一現(xiàn)象可能是由于水相環(huán)境中更有利于形成exo-型過渡態(tài)�,且不利于較不穩(wěn)定的、具有動力學優(yōu)勢的endo,exo型產(chǎn)物向熱力學穩(wěn)定的單環(huán)加成產(chǎn)物轉(zhuǎn)化���。由于a’-亞烷基-2-環(huán)戊烯酮中環(huán)內(nèi)與環(huán)外雙鍵的反應性不同�����,該反應也可以使用兩種不同的偶極子一鍋法產(chǎn)生具有高度立體選擇性的8個立體中心的螺環(huán)化合物�。相關(guān)成果發(fā)表在Angew. Chem. Int. Ed. 2021, 60, 20012-20020上(圖10)�����。
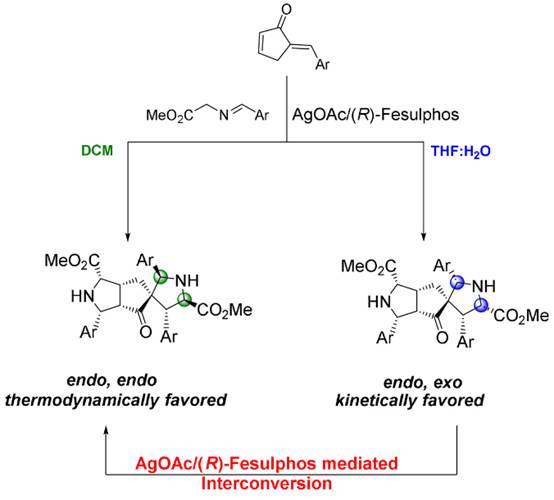
圖10
3)富勒烯參與的1,3-偶極環(huán)加成反應
2014年Martín和Cossío小組開發(fā)了一種新型偶極子(富勒烯-C60)用于銅或銀催化的亞甲胺葉立德的1,3-偶極環(huán)加成反應��,在Cu(OAc)2/(R)-Fesulphos和AgOAc/(R,R)-BPE的催化下可以獲得一對具有高對映選擇性的吡咯烷并[60]富勒烯非對映異構(gòu)體�����。有趣的是���,使用手性α-亞氨基酰胺作為1,3-偶極子會導致雙不對稱誘導效應����,底物α-亞氨基酰胺中立體中心的絕對構(gòu)型與Cu或Ag催化體系產(chǎn)生匹配效應。ESI/MS實驗研究表明�,吡咯烷并[60]富勒烯在逆環(huán)加成反應中也發(fā)現(xiàn)了對映選擇性過程。相關(guān)成果發(fā)表在J. Am. Chem. Soc. 2014, 136, 705−712上(圖11)��。
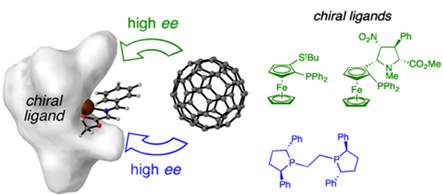
圖11
在此基礎(chǔ)上�����,作者設計使用催化量的手性試劑(Cu(OAc)2/(R)-Fesulphos)實現(xiàn)了螺旋烴與富勒烯的立體發(fā)散的1,3-偶極環(huán)加成反應���,形成的螺旋烴/富勒烯非對映體能夠通過傳統(tǒng)的色譜法很容易分離。隨后通過1,3-偶極環(huán)加成逆反應可以得到高光學純的螺旋烴����,該策略高效地實現(xiàn)了外消旋螺旋烴的手性拆分。相關(guān)成果發(fā)表在Org. Lett. 2018, 20, 1764−1767上(圖12)��。
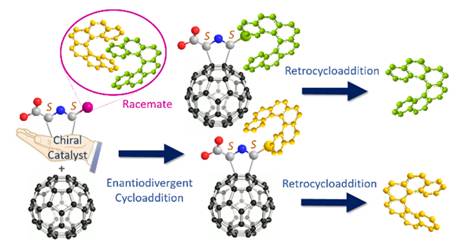
圖12
4���、Mannich反應
烯醇陰離子等當體與亞胺的催化不對稱Mannich反應是構(gòu)建手性非天然β-氨基羰基化合物的重要策略����。2006年Carretero小組利用Cu(I)/Fesulphos作為手性Lewis酸催化劑��,實現(xiàn)了硅基烯醇對N-(2-噻吩基)磺酰基醛亞胺的不對稱加成���,以58-91%的收率��、61-93%的對映選擇性獲得β-氨基羰基化合物���。相關(guān)成果發(fā)表在Org. Lett. 2006, 8, 2977−2980上(圖13)。
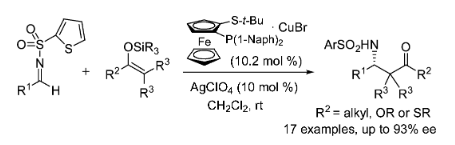
圖13
光學活性的α,b-二氨基酸是生物活性分子的重要骨架�,也是極具價值的合成中間體。席夫堿與亞胺的不對稱Mannich反應是一種構(gòu)建非蛋白氨基酸衍生物的重要方法�。2008年Carretero小組報道了Cu(I)/Fesulphos催化的N-(8-喹啉)磺酰基保護的亞胺與α-亞胺酯的不對稱Mannich反應���,以良好的收率��、優(yōu)異的對映選擇性獲得反式產(chǎn)物��。α,b-二氨基酯可以進一步轉(zhuǎn)化為光學純脲衍生物��,體現(xiàn)了該方法在合成中的應用潛力�。相關(guān)成果發(fā)表在J. Am. Chem. Soc. 2008, 130, 16150−16151上(圖14)�����。
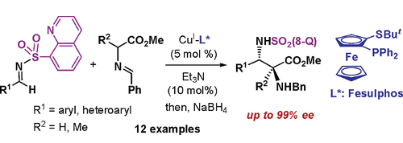
圖14
相關(guān)產(chǎn)品: