編者按:2024年����,美國食品藥品監(jiān)督管理局(FDA)藥物評估與研究中心(CDER)批準了50種新藥(包括小分子藥物����、生物制劑和寡核苷酸治療藥物)。雖然這一數(shù)字略低于2023年的55種�����,但仍然是是過去30年中批準數(shù)量第二多的一年�����。
同類首創(chuàng)藥物(First-in-Class)
2024年��,CDER批準了50種新藥�,其中24種(48%)為同類首創(chuàng)藥物(First-in-Class)�����。這些藥物在治療特定疾病方面展現(xiàn)出了新的藥理作用�,如Anktiva(nogapendekin alfa inbakicept-pmln)用于治療對卡介苗無反應(yīng)的非肌層浸潤性膀胱癌�,Cobenfy(xanomeline and trospium chloride)成為首個治療成人精神分裂癥的毒蕈堿類藥物,Lumisight(pegulicianine)助力乳腺癌的術(shù)中癌組織檢測等���。
罕見病治療藥物
罕見病患者通常面臨治療選擇有限或無藥可用的窘境���。2024年,CDER批準的50種新藥中有26種(52%)用于治療罕見病����,包括針對尼曼-皮克病C型的Aqneursa(levacetylleucine)、用于治療6歲及以上杜氏肌營養(yǎng)不良癥的Duvyzat(givinostat)以及治療原發(fā)性膽汁性膽管炎的Iqirvo(elafibranor)等�����。
抗感染藥物
在抗感染領(lǐng)域�����,2024年獲批的新藥也為臨床治療提供了有力支持:
Exblifep(頭孢吡肟�����,enmetazobactam):用于治療由以下敏感病原體引起的18歲及以上患者的復雜性尿路感染(包括腎盂腎炎):大腸埃希菌、肺炎克雷伯菌�、銅綠假單胞菌、奇異變形桿菌和陰溝腸桿菌復合體�����。
Zevtera(頭孢比羅酯鈉):用于治療成人金黃色葡萄球菌血流感染(菌血癥)�����、急性細菌性皮膚和皮膚結(jié)構(gòu)感染�����,以及成人和兒童(3個月至18歲以下)的社區(qū)獲得性細菌性肺炎����。
Orlynvah(硫培南乙羥氨芐����,丙磺舒):用于治療由特定微生物(大腸埃希菌、肺炎克雷伯菌或奇異變形桿菌)引起的非復雜性尿路感染����,適用于口服抗菌藥治療方案有限或無其他替代治療方案的成年女性患者����。
表1. CDER 2024年獲批新藥
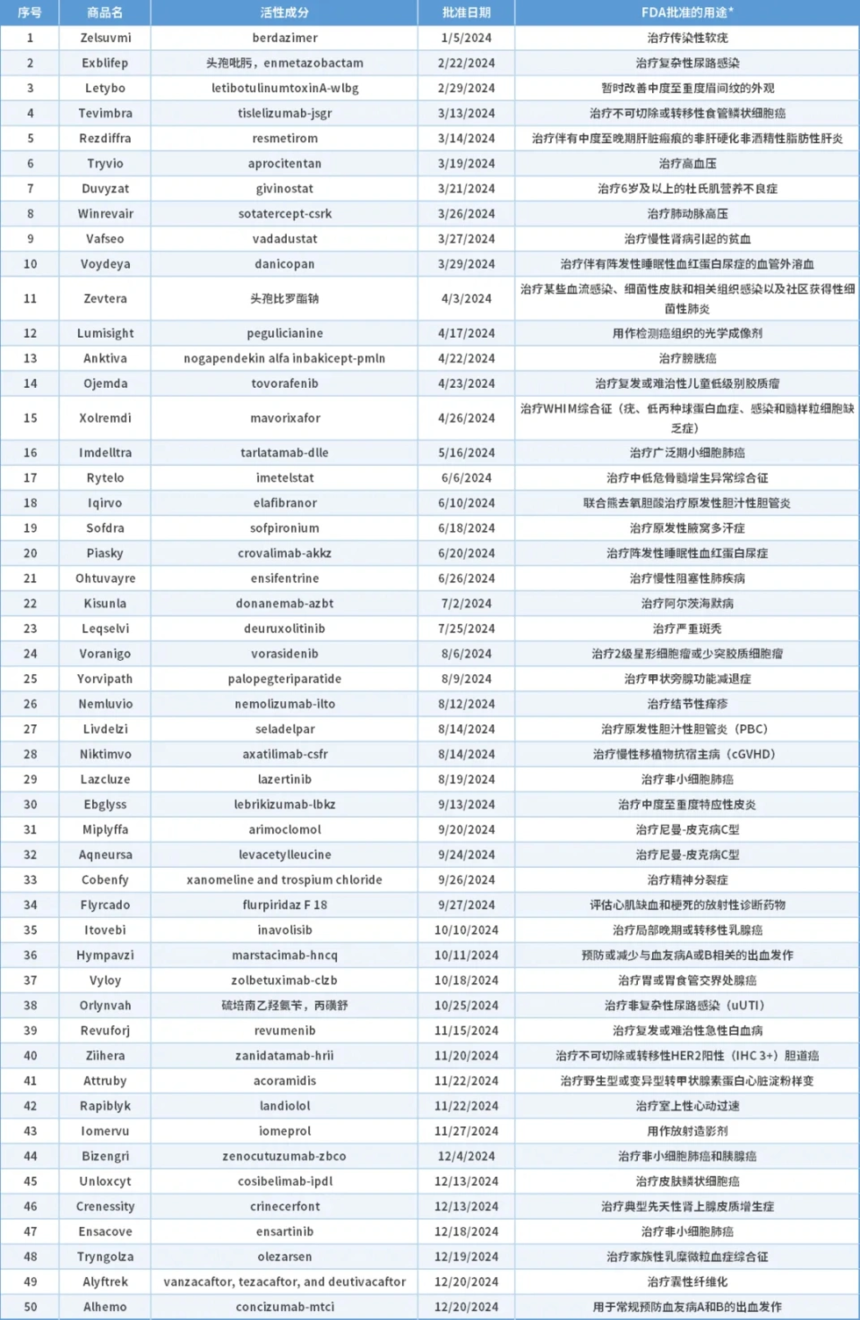
*“FDA批準的用途”僅供介紹����。如需了解FDA批準的每種產(chǎn)品的使用條件(如適應(yīng)證、適用人群��、給藥方案)���,請參閱最新的獲批處方信息����。
轉(zhuǎn)載鏈接:https://news.qq.com/rain/a/20250113A09BPL00
如有侵權(quán)請聯(lián)系我們�,我們將會刪除。