人們使用天然產(chǎn)物作為藥物來預(yù)防����、治療疾病已有上千年歷史。天然產(chǎn)物來源非常豐富,其中微生物來源天然產(chǎn)物����,即微生物藥物是目前開發(fā)臨床抗菌�、抗腫瘤、免疫抑制劑等藥物的重要資源�����,其在農(nóng)業(yè)�、食品、軍事等領(lǐng)域也有廣泛的應(yīng)用��。
微生物藥物是指微生物在生命活動(dòng)過程中產(chǎn)生的具有生理活性的次生代謝產(chǎn)物及其衍生物�����。由于微生物的多樣性��,微生物藥物的分類也是不盡相同的:
(ⅰ) 按照來源可分為來源于微生物整體或部分實(shí)體的藥物���、來源于微生物初級代謝產(chǎn)物的藥物�����、來源于微生物次級代謝產(chǎn)物的藥物����;
(ⅱ) 按照微生物的性質(zhì)可分為海洋微生物藥物、稀有放線菌微生物藥物��、極端微生物藥物等����;
(ⅲ) 按照藥物的結(jié)構(gòu)式及性質(zhì)可分為氨基糖苷類抗生素、核苷類抗生素��、核糖體肽��、萜類�����、聚酮化合物����;
研究人員通常采用結(jié)構(gòu)式的形式對微生物藥物進(jìn)行分類,因?yàn)檫@種分類方法更有助于他們對藥物進(jìn)行分析�����、預(yù)測,從而在研發(fā)的過程中發(fā)掘出更多類似的藥物��。下文將以結(jié)構(gòu)形式的分類方法對微生物藥物進(jìn)行簡單的介紹�,并陳述目前微生物藥物結(jié)合合成生物學(xué)技術(shù)的一些成果。
氨基糖苷類抗生素由氨基環(huán)醇類化合物以配糖鍵的形式與一個(gè)或多個(gè)氨基糖分子配合而成�����,是曾經(jīng)治療細(xì)菌感染的一線臨床藥物�����,如治療由革蘭氏陰性菌所引發(fā)嚴(yán)重感染的慶大霉素�。慶大霉素在人類與病源微生物的抗?fàn)幹凶鞒隽司薮筘暙I(xiàn)�,但隨著普遍的使用,它的耳毒性和腎毒性等毒副作用也凸顯出來����,導(dǎo)致其逐漸被淘汰。但氨基糖苷類抗生素的研發(fā)進(jìn)程并沒有停下���,在研究人員的努力下���,更多的新型氨基糖苷類抗生素被不斷地開發(fā)出來,如Valienamine等。
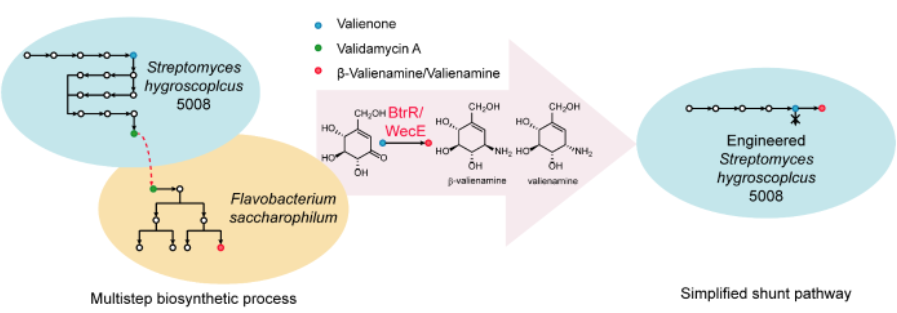
圖1 Valienamine天然多步合成途徑及改造后的簡化合成途徑
(圖源:合成生物學(xué)期刊)
Valienamine(C7N氨基環(huán)醇)是一種新型的氨基糖苷類抗生素����,可用于開發(fā)生物活性的糖苷酶抑制劑,應(yīng)用于2型糖尿病藥物治療領(lǐng)域���,但是由于結(jié)構(gòu)中存在多手性中心���,因此對其進(jìn)行化學(xué)全合成非常困難。馮雁��、白林泉等[1]結(jié)合合成生物學(xué)��,利用了基因重組�、蛋白質(zhì)進(jìn)化等技術(shù),實(shí)現(xiàn)了一步法發(fā)酵生產(chǎn)valienamine�����,大大簡化了常規(guī)生產(chǎn)時(shí)的多個(gè)合成步驟�。這也證明,利用合成生物學(xué)的理念和手段�,可以將已有的合成途徑進(jìn)行理性改造,從而大幅提高藥物效價(jià)�����。
核苷類抗生素應(yīng)用領(lǐng)域廣泛,在臨床上用于治療病毒感染性疾病����,如噴司他丁�����;在農(nóng)業(yè)上用于生物防治植物病蟲害��,如多氧霉素等�。核苷類抗生素的生物合成邏輯并不復(fù)雜���,一般是通過簡單的堿基模塊構(gòu)建復(fù)雜的分子���,但在這個(gè)合成的過程中會涉及到許多復(fù)雜的酶反應(yīng)。
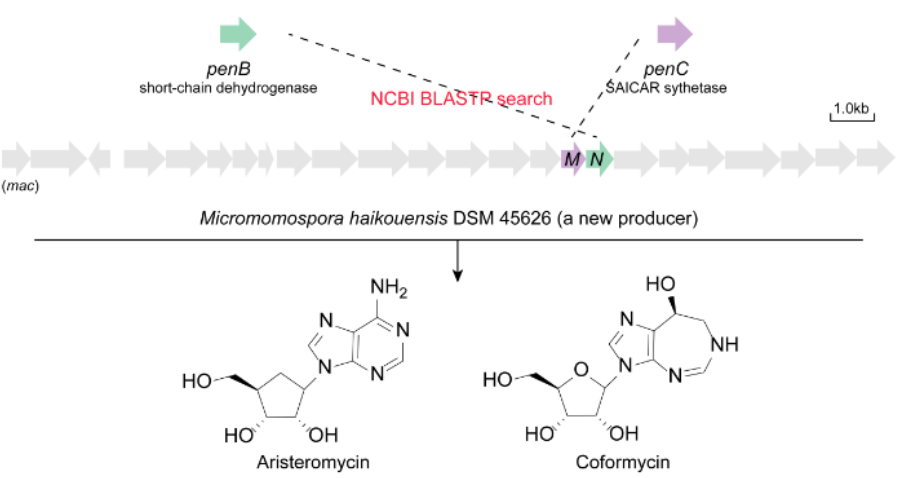
圖2 嘌呤核苷類抗生素的靶向基因組挖掘
(圖源:合成生物學(xué)期刊)
近年來��,核苷類抗生素生物合成領(lǐng)域取得了多項(xiàng)突破����,為通過合成生物學(xué)針對性地制造人工設(shè)計(jì)的核苷類藥物鋪平了道路��,如陳文青等[2]近期報(bào)道了一種靶向基因組挖掘方法�����,尋找并表征了部分嘌呤核苷抗生素的生物合成途徑���,為合理尋找嘌呤類抗生素開辟了新的途徑。
核糖體肽是一大類具有高度結(jié)構(gòu)多樣性和多種生物活性的天然產(chǎn)物���,到目前為止已經(jīng)發(fā)現(xiàn)了20多個(gè)不同的核糖體肽家族�,其中硫肽類抗生素是研究人員投入精力研發(fā)最多的一類核糖體肽����,如那西肽、硫鏈絲菌素����、絲裂霉素等。絲裂霉素(Siomycin)是硫肽抗生素的重要代表���,可有效拮抗多種革蘭氏陽性細(xì)菌�,并易被用作動(dòng)物抗菌劑使用�。
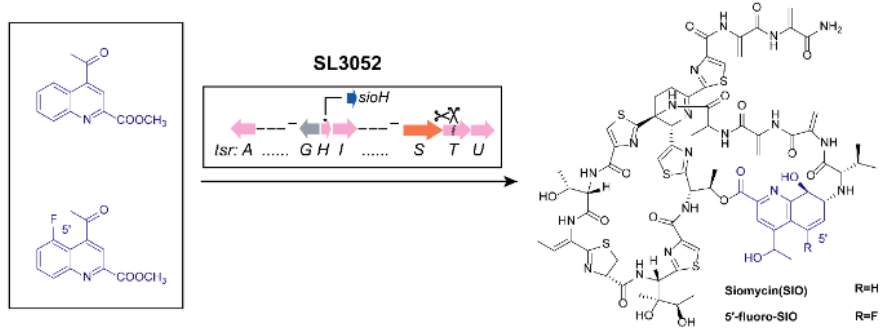
圖3 凸顯了運(yùn)用基因組挖掘和合成生物學(xué)技術(shù)探索核糖體肽的潛力
(圖源:合成生物學(xué)期刊)
劉文等[3]基于硫肽抗生素與原核病原體的構(gòu)效關(guān)系等合成生物學(xué)信息����,構(gòu)建了一個(gè)新型的硫肽化合物組合合成平臺��,提出了利用喹啉酸及其類似物喂養(yǎng)工程菌以生產(chǎn)硫肽抗生素的思路��,凸顯了運(yùn)用合成生物學(xué)技術(shù)探索核糖體肽的潛力����。
萜類是自然界中最為豐富的一類化合物,是概括所有異戊二烯的聚合物以及它們衍生物的總稱��,根據(jù)分子中包括異戊二烯單位的數(shù)目將萜類可分為:單萜��、倍半萜����、二萜���、倍半萜�����、三萜��、四萜�、多萜?�?汞懠菜幬锴噍锼匾约翱拱┧幬镒仙即级紝儆谳祁惢衔?�。時(shí)至今日����,萜類化合物的生物合成的技術(shù)雖然還不夠成熟,但也引起了許多研究人員的研發(fā)熱情�。
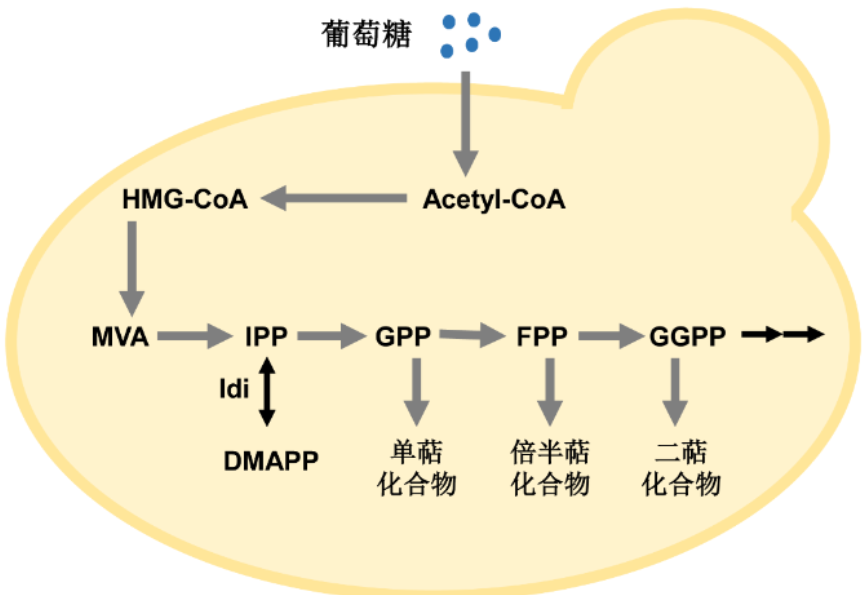
圖4 釀酒酵母中萜類化合物合成通路
(圖源:合成生物學(xué)期刊)
劉天罡等[4]通過對萜類化合物 “定向合成代謝”的深刻理解,構(gòu)建了一個(gè)含有3個(gè)不同模塊(底物供給模塊��、不同異戊二烯前體合成模塊���、萜類合酶模塊)的萜類化合物組合生物合成平臺����,研究不同模塊的生物合成萜類化合物的能力�����。在此基礎(chǔ)上�����,劉天罡等以基因重組改造過的釀酒酵母為工程菌、葡萄糖為原料���,生產(chǎn)了部分新型的倍半萜類化合物���,彰顯了生物合成萜類化合物較好的前景。
聚酮化合物是一類由生物體產(chǎn)生的代謝產(chǎn)物�,其中具有重要藥用價(jià)值的有阿維菌素、土霉素�����、紅霉素等���,它們多為放線菌的次級代謝產(chǎn)物���,主要在菌體生長的穩(wěn)定期產(chǎn)生,但聚酮化合物的發(fā)酵產(chǎn)量卻并不理想����。在研究人員的不斷努力下��,聚酮化合物的生產(chǎn)方法也得到了一定的改進(jìn)。
目前提高聚酮化合物發(fā)酵產(chǎn)量的方法多為改變前體供應(yīng)代謝流�����。以紅霉素為例���,紅霉素的生物合成通常是以丙酰輔酶A為直接前體����,但丙酰輔酶A的過量供應(yīng)會導(dǎo)致高丙?����;鸬姆答佉种?����,從而影響紅霉素的發(fā)酵����,而葉邦策等[5]開發(fā)了一種能解除丙酰基轉(zhuǎn)移酶引起的反饋抑制來提高細(xì)胞中丙酰輔酶A供應(yīng)的策略����,結(jié)果顯示��,基因工程菌株中紅霉素產(chǎn)量比工業(yè)高產(chǎn)菌株Ab高出22%����。改變前體供應(yīng)代謝流方法的發(fā)現(xiàn)提供了一定的在生產(chǎn)過程中提高產(chǎn)物產(chǎn)量的策略����。
有人說,21世紀(jì)是生物工程的世紀(jì)����,這句話雖有些以偏概全,但也不可否認(rèn)生物技術(shù)及其衍生產(chǎn)品正在逐步走入大眾的視野中���,微生物藥物也是如此���,從以往單一的抗生素到現(xiàn)今多種多樣的治療藥物,我們都能看到它們強(qiáng)大的生物活性����、藥理作用,這說明了微生物藥物的應(yīng)用前景十分美好����,但我們也不能因此止步不前,而是應(yīng)該繼續(xù)發(fā)掘更多的東西�,并結(jié)合合成生物學(xué)等相關(guān)理論、技術(shù)��,以此推動(dòng)生物領(lǐng)域的進(jìn)步�����。
參考資料:
[1] CUI Li, ZHU Ying, GUAN Xiaoqing, et al.Denovo biosynthesis of β-valienamine in engineered streptomyces hygroscopicus5008[J]. ACS Synthetic Biology, 2016, 5 (1): 15-20.
[2] XU Gudan, KONG Liyuan, GONG Rong, etal.Coordinated Biosynthesis of the Purine Nucleoside Antibiotics Aristeromycinand Coformycin in Actinomycetes[J]. Appl Environ Microbiol, 2018, 84 (22):e01860-18.
[3] WANG Jian, LIN Zhi, BAI Xuebing, etal.Optimal design of thiostrepton-derived thiopeptide antibiotics and theirpotential application against oral pathogens[J]. Organic Chemistry Frontiers,2019, 6 (8): 1194-1199.
[4] BIAN Guangkai, HOU Anwei, YUAN Yujie,et al.Metabolic Engineering-Based Rapid Characterization of a SesquiterpeneCyclase and the Skeletons of Fusariumdiene and Fusagramineol from Fusariumgraminearum[J]. Organic Letters, 2018, 20 (6): 1626-1629.
[5] YOU Di, WANG Miaomiao, YIN Bincheng, etal.Precursor Supply for Erythromycin Biosynthesis: Engineering of PropionateAssimilation Pathway Based on Propionylation Modification[J]. ACS SyntheticBiology, 2019, 8 (2): 371-380.
封面圖源:網(wǎng)絡(luò)
(文章內(nèi)容源于相關(guān)研究資料的整理��,若有不足之處��,歡迎指正)