01.靶點:USP9X
應用:中樞神經(jīng)系統(tǒng)血管屏障功能障礙相關疾病
來源:Deubiquitinase USP9X controls Wnt signaling
for CNS vascular formation and barrier maintenance.Dev Cell,2025 Jan 31
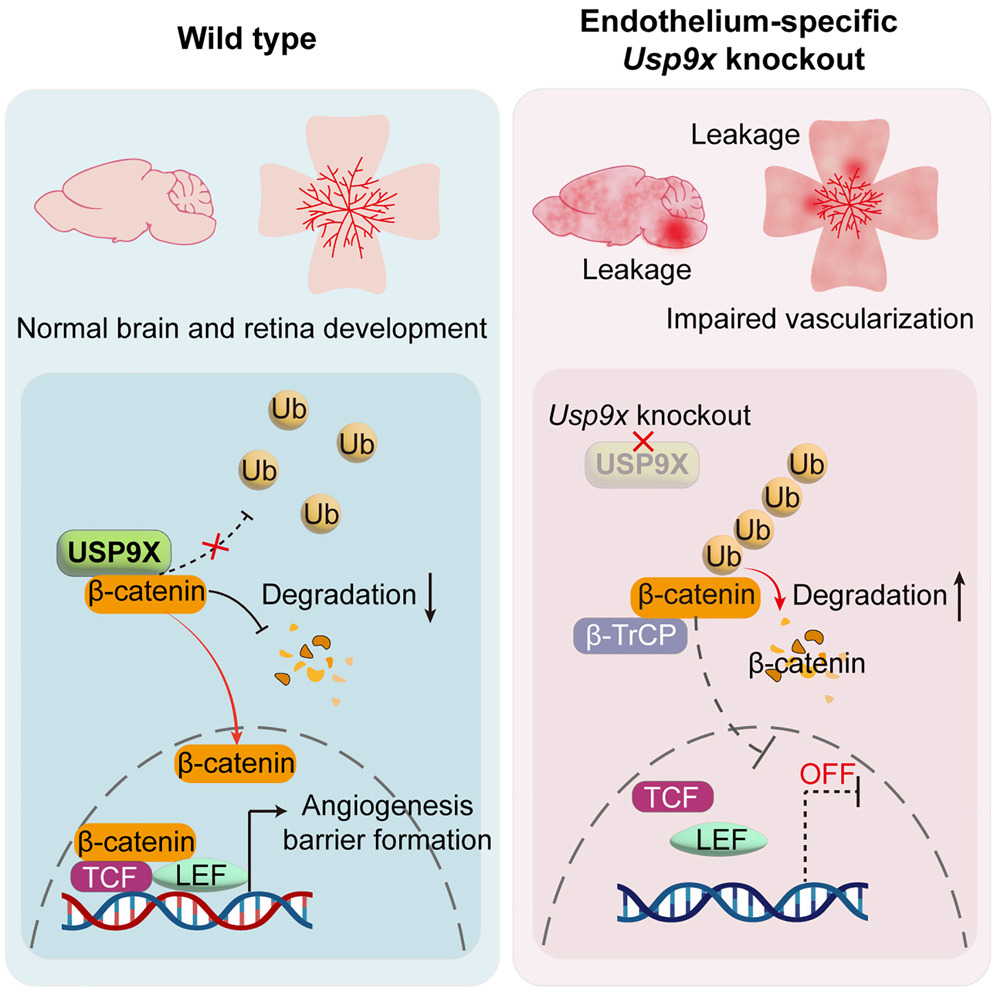
圖源:10.1016/j.devcel.2025.01.009[1]
天津醫(yī)科大學王曉虹教授團隊在《Developmental Cell》發(fā)表研究���,揭示去泛素酶 USP9X 通過調控 Wnt 信號通路����,影響中樞神經(jīng)系統(tǒng)(CNS)血管形成和屏障功能維持。研究發(fā)現(xiàn)�����,USP9X 可去除 β-catenin 的 K48 鏈泛素化,穩(wěn)定其蛋白水平�,維持 Wnt 信號活性。利用血管內皮細胞特異性 USP9X 敲除小鼠�����,發(fā)現(xiàn)內皮細胞中 USP9X 缺失會導致 CNS 血管發(fā)育缺陷�����,且 USP9X 在成年小鼠中維持血腦屏障(BBB)和血視網(wǎng)膜屏障(BRB)完整性�,對其他器官血管屏障無顯著影響。此外���,USP9X 缺失會加劇腦出血模型中的 BBB 破壞和氧誘導視網(wǎng)膜病變模型中的病理性新生血管形成和血管滲漏�����。該研究提示 USP9X 為 CNS 血管發(fā)育和穩(wěn)態(tài)維持的重要調節(jié)因子�����,為相關疾病治療提供新潛在靶點���。
02.靶點:Listerin
應用:帕金森病的潛在治療靶點
來源: Listerin promotes α-synuclein degradation to alleviate Parkinson's disease through the ESCRT pathway.Sci Adv,2025 Feb 14

Listerin與α-突觸核蛋白(α-syn)相互作用并降低其蛋白水平
圖源:10.1126/sciadv.adp3672[2]
山東大學高成江教授團隊在《Science Advances》發(fā)表研究,揭示泛素連接酶 Listerin 通過 ESCRT 途徑促進 α-突觸核蛋白降解����,緩解帕金森病。α-突觸核蛋白的異常積累是帕金森病的關鍵病理特征���,該研究發(fā)現(xiàn) Listerin 與 α-突觸核蛋白相互作用并介導其 K27 位泛素化�,促進其在核內體內的分選和降解�����。實驗表明���,Listerin 表達增加可降低 α-突觸核蛋白水平����,減輕細胞毒性���;在帕金森病小鼠模型中�����,Listerin 缺失加重癥狀��,而過表達 Listerin 則改善行為學表現(xiàn)和病理進展���,為治療帕金森病提供新潛在靶點��。
03.靶點:ADAR1
應用:前列腺癌的潛在治療靶點
來源:Targeting ADAR1 with a small molecule for the treatment of prostate cancer.Nat Cancer,2025 Feb 10

圖源:https://www.nature.com/articles/s43018-025-00907-4[3]
中國藥科大學楊鵬等研究人員在《Nature Cancer》發(fā)表研究�����,發(fā)現(xiàn)高表達的 ADAR1 是前列腺癌的重要致癌靶點�����,并開發(fā)出小分子 ADAR1 抑制劑 ZYS-1�����。該抑制劑能直接結合 ADAR1�,抑制其脫氨酶活性�,通過特異性抑制 ADAR1 激活腫瘤干擾素信號,顯著抑制體內腫瘤生長和轉移���,且能增強抗腫瘤免疫�,與免疫療法組合時效果更強����。研究還揭示 ADAR1 以編輯依賴的方式抑制 MTDH 翻譯�����,驅動前列腺癌細胞增殖和侵襲。該發(fā)現(xiàn)表明 ADAR1 是前列腺癌的藥物靶點����,其抑制劑對廣譜惡性腫瘤有治療潛力。
04.靶點:RPAP2
應用:肝細胞癌的潛在治療靶點
來源:The FBXW7-RPAP2 Axis Controls the Growth of Hepatocellular Carcinoma Cells and Determines the Fate of Liver Cell Differentiation.Adv Sci (Weinh),2025 Feb 11
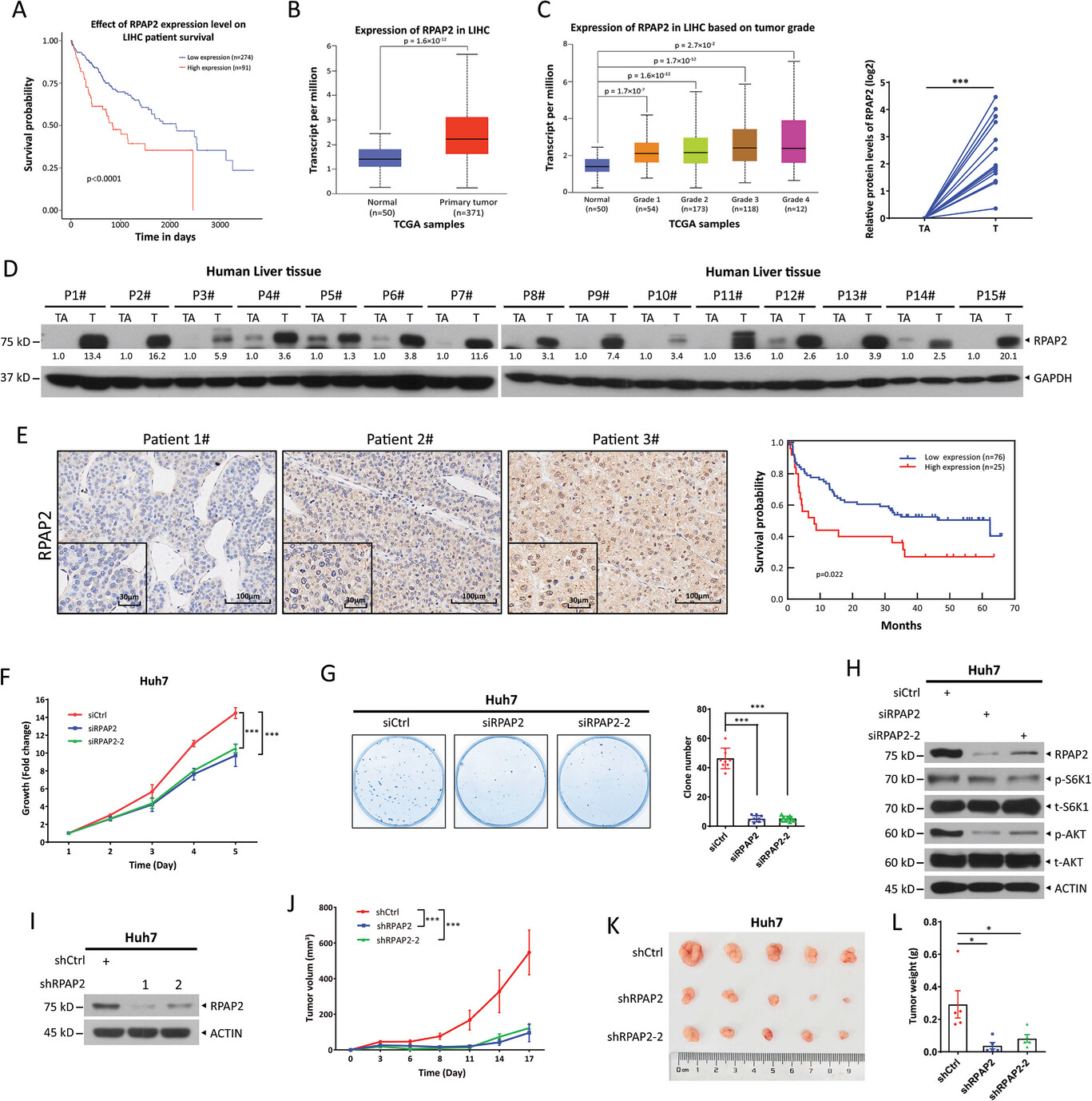
圖源:10.1002/advs.202404718[4]
浙江大學趙永超研究員團隊與熊秀芳副教授���、梁廷波教授��、崔丹蕊團隊合作���,在《Advanced Science》發(fā)表研究,揭示 FBXW7-RPAP2 軸在肝癌發(fā)生和肝臟細胞命運決定中的關鍵作用���。研究發(fā)現(xiàn) RPAP2 在肝癌中高表達��,與不良預后相關�,其促癌特性通過 FBXW7 靶向降解來抑制肝癌細胞生長����。RPAP2 的蛋白穩(wěn)定性受 FBXW7 負向調控及 HSP90 和 USP7 正向調控����。FBXW7-RPAP2 軸不僅影響肝癌細胞生長���,還決定肝臟細胞分化命運���,為靶向 RPAP2 的抗肝癌治療提供新策略。
05.靶點:Lp(a)
應用:動脈粥樣硬化性心血管疾病及其并發(fā)癥
來源:Lipoprotein(a) as a Pharmacological Target: Premises, Promises, and Prospects.Circulation,2025 Feb 11

脂蛋白(a)的結構及其致動脈粥樣硬化機制
圖源:10.1161/CIRCULATIONAHA.124.069210[5]
《循環(huán)》雜志綜述指出���,脂蛋白(a)[Lp(a)] 作為動脈粥樣硬化性心血管疾病的重要獨立危險因素���,正成為藥物干預的關鍵靶點。Lp(a) 水平個體間差異大�,主要受基因影響,全球約 20%~30% 人口 Lp(a) 水平升高�。Lp(a) 與多種心血管疾病相關,其致動脈粥樣硬化性是 LDL 的 5~6 倍���。目前雖無專門獲批用于降低 Lp(a) 的藥物�����,但多種藥物研發(fā)展現(xiàn)潛力�,如 PCSK9 抑制劑、siRNA 藥物及反義寡核苷酸等�。部分現(xiàn)有降脂藥也可降低 Lp(a) 水平。多個指南建議成年人至少進行一次 Lp(a) 檢測��,高危人群應更早檢測����。對于 Lp(a) 升高患者�,除生活方式調整外,還可使用降脂藥���,部分需脂蛋白單采治療���。Lp(a) 作為心血管疾病重要危險因素的地位已獲認可,其檢測和治療有望在預防心血管疾病中發(fā)揮更大作用��。
06.靶點:GUK1
應用:ALK基因重排的非小細胞肺癌
來源:GUK1 activation is a metabolic liability in lung cancer.Cell,2025 Jan 28

圖源:10.1016/j.cell.2025.01.024[6]
哈佛大學醫(yī)學院 2025 年 2 月 6 日在《Cell》發(fā)表的研究��,發(fā)現(xiàn) GDP 合成酶 GUK1 的激活可為肺癌細胞生長提供代謝動力�。研究針對 ALK 基因重排引起的肺癌,通過磷酸化蛋白質組學篩選確定 GUK1 為 ALK 信號傳導靶點�����,證實 ALK 與 GUK1 結合并磷酸化其 Y74 位點,促進 GDP 合成�,對腫瘤生長重要。GUK1 磷酸化還通過調控 Ras-GTP 負載影響 MAPK 信號通路��。該發(fā)現(xiàn)揭示肺癌代謝脆弱性�,GUK1 有望成新型癌癥療法靶點。
07.靶點:SLFN11
應用:DNA損傷敏感性癌癥?(如小細胞肺癌���、肝細胞癌�����、BRCA突變腫瘤)
來源:SLFN11-mediated ribosome biogenesis impairment induces TP53-independent apoptosis.Mol Cell,2025 Jan 30
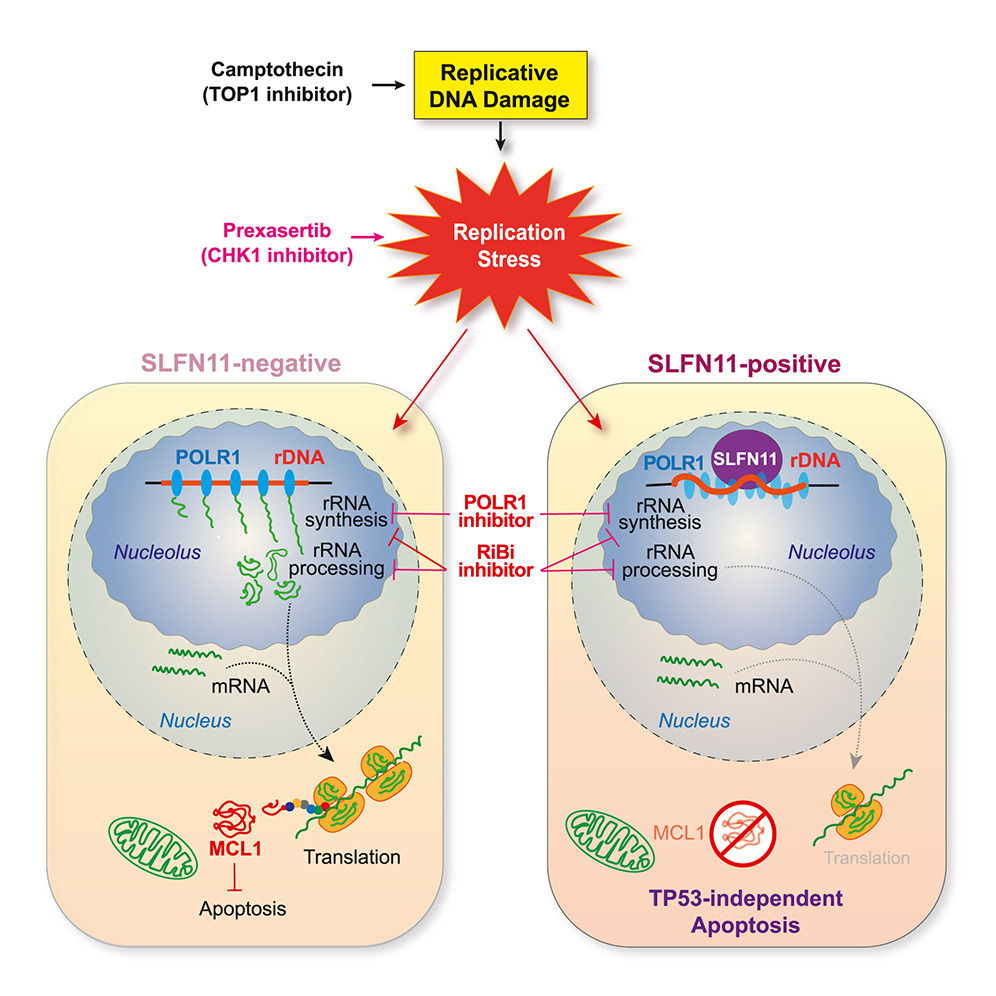
圖源:10.1016/j.molcel.2025.01.008[7]
日本慶應大學 Junko Murai 團隊在《Molecular Cell》發(fā)表文章�,揭示 SLFN11 通過損害核糖體生物合成(RiBi)來誘導 TP53 非依賴性凋亡的新機制�����。SLFN11 是一種與 DNA 復制靶向抗癌藥物敏感性密切相關的基因���,其編碼蛋白具有 RNA 酶活性���,能抑制蛋白質合成并引發(fā)復制應激��。研究發(fā)現(xiàn)����,在復制應激條件下�����,SLFN11 能選擇性抑制新生 RNA 合成�����,特別是 rRNA 合成��,導致核糖體生物合成受損�����,進而抑制整體翻譯�,消耗短壽命蛋白如 MCL1��,最終誘導細胞凋亡�。這一機制被稱為 RIMA(RiBi 受損 - MCL1 減少 - 凋亡)。此外,SLFN11 誘導的凋亡在多種癌細胞系中具有普適性�,且與 RiBi 受損和 rRNA 合成抑制密切相關,為開發(fā)新的抗癌治療策略提供了潛在靶點��。
08.靶點:FXR
應用:肝膽疾病�、代謝綜合征、腸道炎癥及癌癥
來源:Targeting farnesoid X receptor as aging intervention therapy.Acta Pharm Sin B,2025 Jan 19
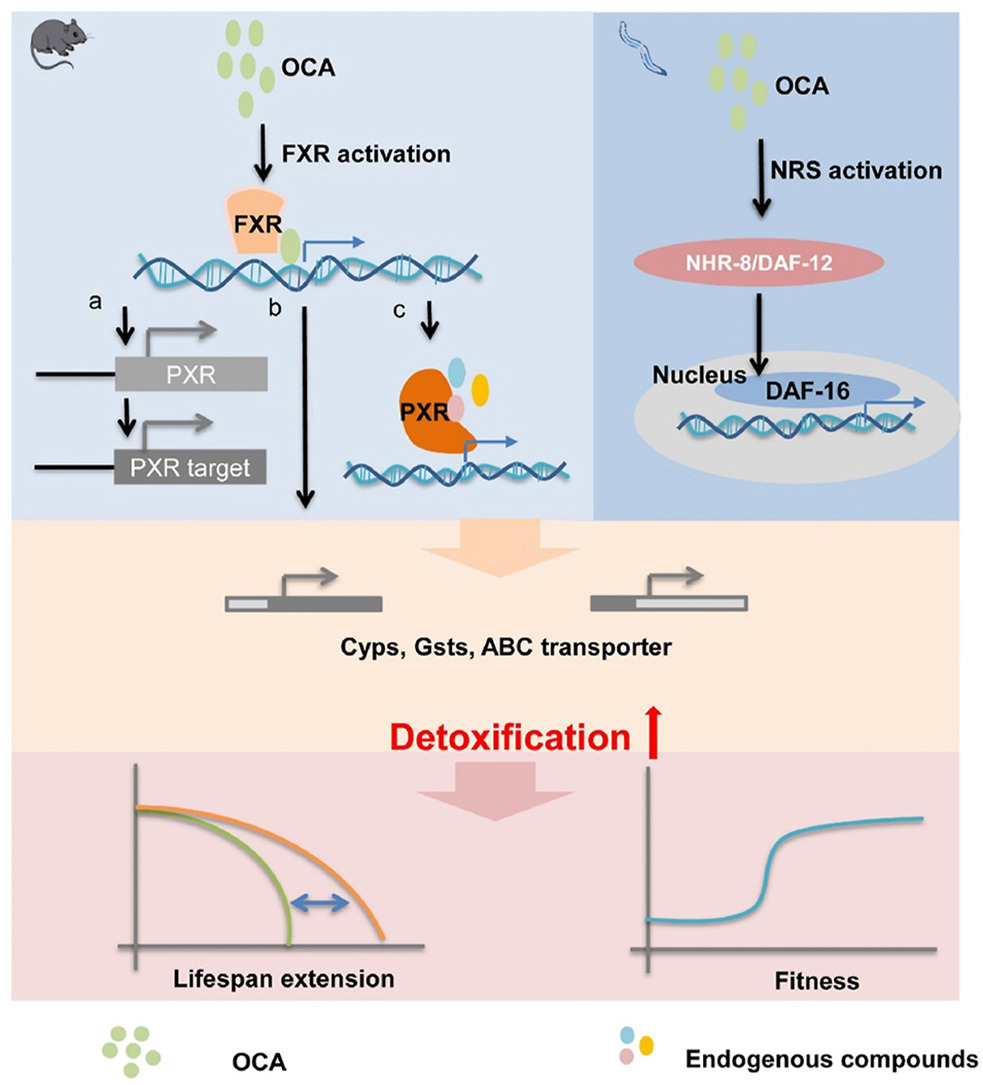
在秀麗隱桿線蟲和小鼠中��,OCA通過直接和/或間接激活FXR介導的解毒來延長壽命和改善健康���。
圖源:https://doi.org/10.1016/j.apsb.2025.01.006[8]
上海中醫(yī)藥大學研究團隊在《Acta Pharmaceutica Sinica B》發(fā)表成果�����,揭示靶向核受體 FXR 的抗衰老機制�����。研究利用秀麗隱桿線蟲和早衰小鼠模型�,發(fā)現(xiàn) FXR 激動劑如奧貝膽酸及中藥化合物桑皮黃酮�����,能通過激活 FXR 及其同源核受體����,調節(jié)解毒基因表達��,改善線蟲和小鼠的健康壽命與自然壽命����。代謝組學分析顯示�����,F(xiàn)XR 激活可增加小鼠肝臟中 PXR 內源激動劑水平��,增強解毒與代謝功能�,從而發(fā)揮抗衰老作用。該研究為抗衰老治療提供新靶點���,具有潛在應用價值��。
09.靶點:PPP6C
應用:代謝功能障礙相關脂肪性肝炎及其相關肝纖維化
來源:Protein phosphatase 6 regulates metabolic dysfunction-associated steatohepatitis via the mTORC1 pathway.J Hepatol,2025 Feb 11

圖源:10.1016/j.jhep.2025.02.003[9]
中國科學院上海營養(yǎng)與健康研究所李于團隊在《Journal of Hepatology》發(fā)表研究,發(fā)現(xiàn) PPP6C 介導 FGF21 治療肝纖維化與代謝功能障礙相關脂肪性肝炎(MASH)的新機制�。研究構建了肝臟肝細胞特異性 FGF21 輔受體 βKlotho 敲除小鼠,發(fā)現(xiàn)肝細胞中 βKlotho 對 FGF21 改善 MASH 的效果至關重要��。通過蛋白質相互作用質譜技術�����,鑒定出 PPP6C 為肝細胞內 FGF21 的直接下游靶點,其與 βKlotho 結合響應 FGF21 信號��,介導 FGF21 對 MASH 的調控���。進一步研究發(fā)現(xiàn)�����,F(xiàn)GF21 促使 βKlotho���、PPP6C 與 TSC2 形成三元復合物,激活 PPP6C 磷酸酶活性�,降低 TSC2 磷酸化水平,抑制 mTORC1 信號通路活性�����,促進脂質合成和脂肪酸氧化基因的關鍵調控轉錄因子 TFE3 和 Lipin1 核轉位�����,從而調控 MASH 疾病進程���。該研究確定 PPP6C 為肝細胞中 FGF21 信號調節(jié) MASH 發(fā)展的直接靶點���,提示靶向肝細胞 PPP6C 活性可能為治療肝纖維化和 MASH 提供新潛在靶點����。
參考文獻
[1] Deubiquitinase USP9X controls Wnt signaling for CNS vascular formation and barrier maintenance.Dev Cell,2025 Jan 31
[2] LiTargeting ADAR1 with a small molecule for the treatment ofsterin promotes α-synuclein degradation to alleviate Parkinson's disease through the ESCRT pathway.Sci Adv,2025 Feb 14
[3] prostate cancer.Nat Cancer,2025 Feb 10
[4] The FBXW7-RPAP2 Axis Controls the Growth of Hepatocellular Carcinoma Cells and Determines the Fate of Liver Cell Differentiation.Adv Sci (Weinh),2025 Feb 11
[5] Lipoprotein(a) as a Pharmacological Target: Premises, Promises, and Prospects.Circulation,2025 Feb 11
[6] GUK1 activation is a metabolic liability in lung cancer.Cell,2025 Jan 28
[7] SLFN11-mediated ribosome biogenesis impairment induces TP53-independent apoptosis.Mol Cell,2025 Jan 30
[8] Targeting farnesoid X receptor as aging intervention therapy.Acta Pharm Sin B,2025 Jan 19
[9] Protein phosphatase 6 regulates metabolic dysfunction-associated steatohepatitis via the mTORC1 pathway.J Hepatol,2025 Feb 11