PI3K是一種胞內(nèi)磷脂酰肌醇激酶,與Src和RAS等癌基因的產(chǎn)物相關(guān)�����。PI3K信號通路是人類癌癥中最常被激活的信號通路之一�����,幾乎介導50%惡性腫瘤的發(fā)生。研究表明��,PI3K信號通路的過度活躍與腫瘤的進展���、腫瘤微血管密度的增加��、癌細胞的趨化性和侵襲性增強有顯著的相關(guān)性��。目前��,PI3K已成為治療各種惡性腫瘤的重要靶點��,包括乳腺癌和濾泡性淋巴瘤等����。
PI3K靶點介紹
磷脂酰肌醇-3-激酶(PI3K)是一種脂質(zhì)激酶�����,在各種生理活動中發(fā)揮著關(guān)鍵作用����。PI3K可以通過多種細胞表面信號被激活�����,如受體酪氨酸激酶(RTKs)、小分子GTPase蛋白和G蛋白偶聯(lián)受體(GPCRs)�。
具體而言,PI3K激酶在ATP作用下����,將4,5二磷酸肌醇磷脂(phosphoinositol 4,5-diphosphate,PIP2)轉(zhuǎn)化為第二信使3,4�,5-三磷酸肌醇磷脂(PIP3)。然后�����,PIP3進一步激活各種下游信號傳導并調(diào)節(jié)細胞生長����,存活,繁衍�,凋亡,轉(zhuǎn)移和代謝�。
PI3K抑制劑的分類
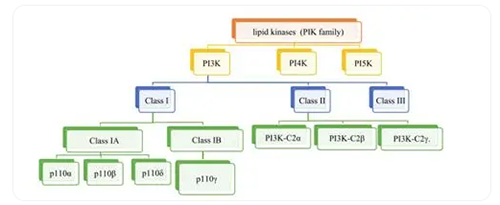
PI3K作為脂質(zhì)激酶家族,可根據(jù)其結(jié)構(gòu)和底物特異性分為三個主要類別I、II 和 III 類�。I類是研究最廣泛的亞型,又可以細分為1A(PI3Kα�、PI3Kβ、PI3Kδ)和1B型(PI3Kγ)���,分別調(diào)節(jié)酪氨酸激酶受體和G蛋白偶聯(lián)受體的信號通路��。PI3Kα和PI3Kβ在所有組織中都有表達��,敲除任何一種都是致命的��。值得注意的是���,PI3Kδ和PI3Kγ在白細胞中高度富集,PI3Kδ或PI3Kγ敲除或激酶失活的小鼠是能存活且具有生育能力的�����,這表明PI3K抑制劑為實現(xiàn)治療效果時各亞型選擇性的重要性����。PI3Kδ的抑制作用已被證明可減少多種血液學癌細胞的增殖而不損害正常免疫細胞的生存能力。鑒于PI3Kδ在促進腫瘤進展中的關(guān)鍵作用及其在白細胞中的限制性表達��,抑制PI3Kδ激酶是治療血液學惡性腫瘤中一個獨特的機會。
PI3K藥物的發(fā)展
2014年�����,PI3Kδ抑制劑Idelalisib已被美國食品藥品監(jiān)督管理局批準用于治療復發(fā)性慢性淋巴細胞白血?���。–LL)����、濾泡性淋巴瘤(FL)、小淋巴細胞淋巴瘤(SLL)和非霍奇金淋巴瘤(NHL)���。
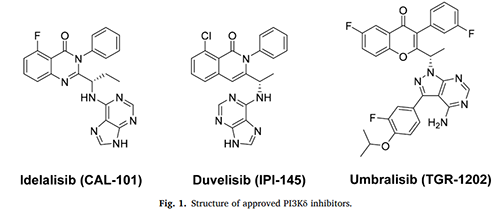
然而�����,Idelalisib可引起一系列嚴重的不良反應���,包括嚴重腹瀉或結(jié)腸炎,致命的肝毒性甚至死亡����,從而導致對PI3Kδ抑制劑持續(xù)性地進行化學結(jié)構(gòu)修飾。2018年,雙效PI3Kδ/γ抑制劑Duvelisib已被批準用于治療成人復發(fā)或難治性CLL���、SLL和FL疾病���,但存在≥3級不良反應發(fā)生率高和具有劑量限制性毒性的缺陷。最近���,Umbralisib這種雙PI3Kδ/CK1ε抑制劑�����,已被美國食品藥品監(jiān)督管理局批準用于治療邊緣區(qū)淋巴瘤(MZL)和濾泡性淋巴瘤(FL)�����。
小結(jié)
多項研究均指出PI3K是一個具有臨床潛力的抗癌靶點�����,并且已經(jīng)成功推動了5款PI3K藥物上市���。但目前,針對PI3K抑制劑的藥物選擇性����、耐藥性以及安全性問題�,卻始終沒有一個完美的“參考答案”��。其中�,安全性問題是PI3K抑制劑的首要解決問題。期待更多安全有效的PI3K抑制劑獲批上市�,造福腫瘤相關(guān)患者。
References:
1.Cantley LC. The phosphoinositide 3-kinase pathway. Science.
2002;296:1655–1657.
2.Vivanco I, Sawyers CL. The phosphatidylinositol 3-kinase-AKT pathway in human cancer. Nat Rev Cancer.
2002;2:489–501.
3.Fruman DA, Chiu H, Hopkins BD, Bagrodia S, Cantley LC, Abraham RT. The PI3K pathway in human disease. Cell.
2017;170:605–635.
4.Osaki M, Oshimura M, Ito H. PI3K-Akt pathway: Its functions and alterations in human cancer. Apoptosis.
2004;9:667–676.
5.Fruman DA, Rommel C. PI3K and cancer: lessons, challenges and opportunities. Nat Rev Drug Discovery.
2014;13:140–156.
6.Thorpe LM, Yuzugullu H, Zhao JJ. PI3K in cancer: divergent roles of isoforms, modes of activation and therapeutic targeting. Nat Rev Cancer.
2015;15:7–24.
7.Engelman JA, Luo J, Cantley LC. The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism. Nat Rev Genet.
2006;7:606–619.
8.Liu PX, Cheng HL, Roberts TM, Zhao JJ. Targeting the phosphoinositide 3-kinase pathway in cancer. Nat Rev Drug Discov.
2009;8:627–644.
9.Vanhaesebroeck B, Ali K, Bilancio A, Geering B, Foukas LC. Signalling by PI3K isoforms: insights from gene-targeted mice. Trends Biochem Sci.
2005;30:194–204.
10.Samuels Y, Ericson K. Oncogenic PI3K and its role in cancer. Curr Opin Oncol.
2006; 18:77–82.
11.Yang QS, Modi P, Newcomb T, Queva C, Gandhi V. Idelalisib: First-in-class PI3K delta inhibitor for the treatment of chronic lymphocytic leukemia, small lymphocytic leukemia, and follicular lymphoma. Clin Cancer Res.
2015;21:1537–1542.
12.Garces AE, Stocks MJ. Class 1 PI3K clinical candidates and recent inhibitor design strategies: a medicinal chemistry perspective. J Med Chem.
2019;62:4815–4850.
13.Greenwell IB, Flowers CR, Blum KA, Cohen JB. Clinical use of PI3K inhibitors in Bcell lymphoid malignancies: today and tomorrow. Expert Rev Anticanc.
2017;17: 271–279.