Berylliumchlorid Chemische Eigenschaften,Einsatz,Produktion Methoden
ERSCHEINUNGSBILD
FARBLOSE BIS GELBE KRISTALLE.
CHEMISCHE GEFAHREN
Schnelle Zersetzung bei Kontakt mit Wasser unter Bildung von Chlorwasserstoff (s. ICSC-Nr. 0163). Greift viele Metalle in Gegenwart von Wasser an.
ARBEITSPLATZGRENZWERTE
TLV: (als Be) 0.002 mg/m?(als TWA); 0.01 mg/m?(als STEL); Krebskategorie A1(best?tigte krebserzeugende Wirkung beim Menschen); Beabsichtigte ?nderung; 0,00005 mg/m?als TWA; 0,0002 mg/m?as STEL; Hautresorption Sensibilisierung Krebskategorie A1(best?tigte krebserzeugende Wirkung beim Menschen); (ACGIH 2008).
MAK: Sensibilisierung der Atemwege und der Haut; Krebserzeugend Kategorie 1 (DFG 2008).
AUFNAHMEWEGE
Aufnahme in den K?rper durch Inhalation des Aerosols und durch Verschlucken.
INHALATIONSGEFAHREN
Verdampfung bei 20°C vernachl?ssigbar; eine gesundheitssch?dliche Partikelkonzentration in der Luft kann jedoch beim Dispergieren schnell erreicht werden.
WIRKUNGEN BEI KURZZEITEXPOSITION
WIRKUNGEN BEI KURZZEITEXPOSITION: Die Substanz reizt stark die Augen, die Haut und die Atemwege. Inhalation von Staub oder Rauchen kann zu chemischer Pneumonie führen. Die Auswirkungen treten u.U. verz?gert ein. ?rztliche Beobachtung notwendig. Exposition kann zum Tod führen.
WIRKUNGEN NACH WIEDERHOLTER ODER LANGZEITEXPOSITION
Wiederholter oder andauernder Hautkontakt kann zu Hautsensibilisierung führen. Risiko der Lungensch?digung bei wiederholter oder l?ngerer Exposition mit nachfolgender chronischer Berylliose (Husten, Gewichtsverlust, Schw?che). Krebserzeugend für den Menschen.
LECKAGE
Verschüttetes Material in abdichtbaren Beh?ltern sammeln; falls erforderlich durch Anfeuchten Staubentwicklung verhindern. Reste sorgf?ltig sammeln. An sicheren Ort bringen. NICHT in die Umwelt gelangen lassen. Chemikalienschutzanzug mit umgebungsluftunabh?ngigem Atemschutzger?t.
R-S?tze Betriebsanweisung:
R49:Kann Krebs erzeugen beim Einatmen.
R25:Giftig beim Verschlucken.
R26:Sehr giftig beim Einatmen.
R36/37/38:Reizt die Augen, die Atmungsorgane und die Haut.
R43:Sensibilisierung durch Hautkontakt m?glich.
R48/23:Giftig: Gefahr ernster Gesundheitssch?den bei l?ngerer Exposition durch Einatmen.
R51/53:Giftig für Wasserorganismen, kann in Gew?ssern l?ngerfristig sch?dliche Wirkungen haben.
S-S?tze Betriebsanweisung:
S53:Exposition vermeiden - vor Gebrauch besondere Anweisungen einholen.
S45:Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn m?glich, dieses Etikett vorzeigen).
S61:Freisetzung in die Umwelt vermeiden. Besondere Anweisungen einholen/Sicherheitsdatenblatt zu Rate ziehen.
Chemische Eigenschaften
Beryllium chloride is available as colorless to yellow crystals. It decomposes rapidly on
contact with water producing hydrogen chloride, and attacks many metals in the presence
of water. Beryllium chloride emits irritating or toxic fumes (or gases) in a fi re.
Physikalische Eigenschaften
Beryllium chloride has the formula BeCl2 with a molecular weight of 79.9176 g/mol. Beryllium chloride, BeCl2, melts at 405°C and boils at 520°C. That compares with 714°C and 1412°C for magnesium chloride. The solid is a one-dimensional polymer consisting of edge-shared tetrahedra. In contrast, BeF2 is a threedimensional polymer, with a structure akin to that of quartz. In the gas phase, BeCl2 exists both as a linear monomer and a bridged dimer with two bridging chlorine atoms where the beryllium atom is 3-coordinate. This linear shape contrasts with the monomeric forms of some of the dihalides of the heavier members of group 2, e.g. CaF2, SrF2, BaF2, SrCl2, BaCl2 and Ba that are all nonlinear.
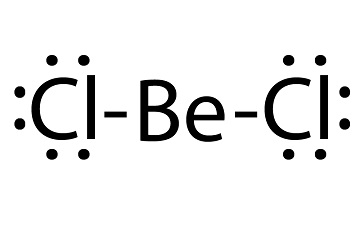
beryllium chloride lewis structure
The pure chloride is a glassy, transparent mass having a specific gravity of 2.01 at 15°C. It becomes fluid toward 440°C, passing through a viscous condition, but above 800° C it begins to volatilize, yielding white and very deliquescent crystals. It dissolves readily in water, but is only slightly soluble in absolute alcohol. By cooling an alcoholic solution to 23°C, one can obtain a white crystalline mass which, however, melts easily as the temperature rises.
Beryllium chloride, an electron-deficient compound similar to aluminum chloride, is a Lewis acid. The anhydrous salt is used as a catalyst in organic reactions.
History
Although early workers (1798) obtained the chloride
in solution, the pure salt was not made until about
1827 when one worker of the time prepared it in the
sublimed anhydrous state by passing chlorine gas over
a heated mixture of carbon and beryllium oxide. Finally
(1885), it was prepared as the pure chloride in very pure
form for the purpose of determining its vapor density by
the action of dry hydrochloric acid gas on the metal, but
the pure salt was not produced until 1898 when one
worker made it by heating the double fluoride of ammonium
and beryllium, which had previously been dried
over phosphoric anhydride, in a current of dry carbon
dioxide and cooled in an atmosphere of the same gas.
He also prepared it by the action of hydrofluoric acid
gas on the carbide. No matter what method is used, it
was determined that the materials must be absolutely
dry if a pure chloride is to be obtained.
Verwenden
Beryllium chloride (BeCl2) is used as a catalyst to accelerate many organic reactions, and
beryllium chloride is the electrolyte used along with NaCl in the electrolytic process to produce
beryllium metal.
Definition
ChEBI: A compound of beryllium (+2 oxidation state) and chloride in the ratio 1:2.
synthetische
Beryllium chloride is prepared by passing chlorine over beryllium oxide and carbon:
BeO + C + Cl
2 → BeCl
2 + CO
It also is made by combination of beryllium with chlorine.
Allgemeine Beschreibung
White to green solid with a sharp odor.
Air & Water Reaktionen
Reacts with water with evolution of heat. Forms beryllium oxide and hydrochloric acid solution. Corrodes most metals in presence of moisture. Flammable and explosive hydrogen gas may collect in enclosed spaces [USCG, 1999].
Reaktivit?t anzeigen
Acidic salts, such as BERYLLIUM CHLORIDE, are generally soluble in water. The resulting solutions contain moderate concentrations of hydrogen ions and have pH's of less than 7.0. They react as acids to neutralize bases. These neutralizations generate heat, but less or far less than is generated by neutralization of inorganic acids, inorganic oxoacids, and carboxylic acid. They usually do not react as either oxidizing agents or reducing agents but such behavior is not impossible. Many of these compounds catalyze organic reactions. BERYLLIUM CHLORIDE reacts with vigor with sulfur nitrides. Some explode upon intimate mixing, i.e. tetrasulfur tetranitride.
Hazard
Very toxic.
Health Hazard
Exposures to beryllium chloride cause redness, pain and blurred vision, nausea, vomiting,
and abdominal pain. Inhalation of beryllium chloride causes cough, sore throat, shortness
of breath
Brandgefahr
Special Hazards of Combustion Products: Toxic and irritating beryllium oxide fumes and hydrogen chloride may form in fires.
Sicherheitsprofil
Confirmed carcinogen withexperimental tumorigenic data. Poison by ingestion andintraperitoneal routes. An experimental teratogen. Otherexperimental reproductive effects. Mutation data reported.When heated to decomposition it emits very toxic fumesof
Synthese
Beryllium chloride can be prepared directly from beryl by chloride or by chlorination of beryllium oxide under reducing conditions. Beryllium chloride is especially well suited for purification by distillation in a stream of hydrogen and fractional condensation. The significantly lower-boiling chlorides of aluminum, silicon, and iron(III) can be separated by careful temperature control. Iron(II) chloride, which is reduced by hydrogen, stays in the residue.
Berylliumchlorid Upstream-Materialien And Downstream Produkte
Upstream-Materialien
Downstream Produkte

